题目内容
13.用铝箔包着4.6g金属钠,放入足量水中,放出的H2体积(标准状况)是( )| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
分析 铝箔成分是表面为氧化铝的金属铝,氧化铝、金属铝都和强碱溶液反应,其中铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;金属钠放入水中剧烈反应生成氢氧化钠和氢气,铝与氢氧化钠溶液反应生成氢气,导致生成氢气的体积变大,据此进行解答.
解答 解:钠与水反应为:2Na+2H2O=2NaOH+H2↑,4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,根据化学方程式得生成氢气0.1mol,标况下的体积为2.24L,
铝箔表面氧化铝是两性氧化物,与氢氧化钠溶液反应,金属铝与氢氧化钠溶液反应也生成氢气,故生成氢气体积大于2.24L,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
6.下表是元素周期表的一部分,回答下列有关问题:
(1)元素⑦在元素周期表中的位置第三周期ⅥA族,画出⑥的原子结构示意图: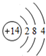 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.
(2)元素③、⑩的最高价氧化物水化物的碱性最强的为KOH;元素②、⑧的氢化物稳定性最强的是HF;表中①-⑫化学性质最稳定的是Ar(均用化学式填空).
(3)在水溶液中⑧的单质与⑫的简单阴离子可发生反应,其离子方程式为:Cl2+2Br-=2Cl-+Br2.
(4)③、⑤两种元素的最高价氧化物的水化物的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.(2)元素③、⑩的最高价氧化物水化物的碱性最强的为KOH;元素②、⑧的氢化物稳定性最强的是HF;表中①-⑫化学性质最稳定的是Ar(均用化学式填空).
(3)在水溶液中⑧的单质与⑫的简单阴离子可发生反应,其离子方程式为:Cl2+2Br-=2Cl-+Br2.
(4)③、⑤两种元素的最高价氧化物的水化物的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O.
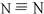 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式
,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式 ;
; (或
(或 ).
).