题目内容
6.下表是元素周期表的一部分,回答下列有关问题:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.(2)元素③、⑩的最高价氧化物水化物的碱性最强的为KOH;元素②、⑧的氢化物稳定性最强的是HF;表中①-⑫化学性质最稳定的是Ar(均用化学式填空).
(3)在水溶液中⑧的单质与⑫的简单阴离子可发生反应,其离子方程式为:Cl2+2Br-=2Cl-+Br2.
(4)③、⑤两种元素的最高价氧化物的水化物的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br.
(1)元素⑦在元素周期表中的位置:第三周期ⅥA族,⑥为Si,核外电子数为14,结合核外电子排布书写原子结构示意;①的气态氢化物为氨气;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,金属性越强,最高价氧化物对应的水化物的碱性越强,氢化物稳定性与元素非金属性一致;稀有气体原子为稳定结构,化学性质最不活泼;
(3)利用氧化溴离子为溴单质,自身被还原为氯离子;
(4)③、⑤两种元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br.
(1)元素⑦在元素周期表中的位置:第三周期ⅥA族,⑥为Si,核外电子数为14,原子结构示意为 ;①的气态氢化物为NH3,
;①的气态氢化物为NH3,
故答案为:第三周期ⅥA族; ;NH3;
;NH3;
(2)金属性K>Na,故碱性KOH>NaOH,非金属性F>Cl,故氢化物稳定性HF>HCl,稀有气体原子为稳定结构,故Ar的化学性质最不活泼,
故答案为:KOH;HF;Ar;
(3)利用氧化溴离子为溴单质,自身被还原为氯离子,反应离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
(4)③、⑤两种元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,二者反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,侧重对化学用语与元素周期律的考查,熟练掌握前四周期元素中在周期表中的位置.

 寒假学与练系列答案
寒假学与练系列答案| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
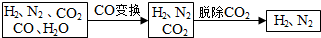
完成下列填空:
(1)半水煤气含有少量硫化氢.将半水煤气样品通入硝酸铅(或硫酸铜)溶液中(填写试剂名称),出现黑色沉淀,可以证明有硫化氢存在.
(2)半水煤气在铜催化下实现CO变换:CO+H2O$→_{△}^{Cu}$CO2+H2,若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=3:1.
(3)碱液吸收法是脱除二氧化碳的方法之一.已知:
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案.取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数.
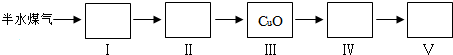
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中.
②该实验方案中,步骤IV(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数.

| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 苯是最简单的芳香烃 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |

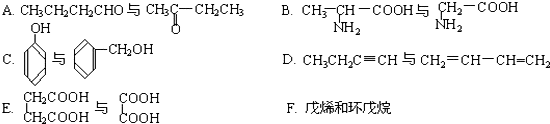
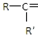 $\frac{\underline{\;氧化成\;}}{\;}$
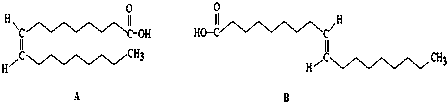
$\frac{\underline{\;氧化成\;}}{\;}$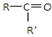 (R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
(R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.