题目内容
1.水在人体中的作用有:水是人体的重要组成部分;水是多种体内物质发生化学反应的催化剂、介质以及反应物;水可调节人体的体温;人们习惯上按不同的溶解性,把维生素分为酯溶性维生素和水溶性维生素两大类,维生素C属于水溶性,其溶液显酸性,人体缺少维生素C会患坏血病,所以维生素C又称为抗坏血酸.
分析 水的比热较大,人体中大量的水具有调节体温的作用;
水溶性维生素主要包括维生素B1、维生素B2和维生素C等,维生素C又称为抗坏血酸.
解答 解:水的比热较大,人体中大量的水具有调节体温的作用,
维生素C属于水溶性维生素,它能防治坏血病,所以维生素C又称为抗坏血酸,
故答案为:体温;抗坏血酸.
点评 本题考查了水在人体中的作用,维生素C的作用,题目简单,用化学认识生活,提高了学科素养.

练习册系列答案
相关题目
11.有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是( )
| A. | 同浓度的AOH溶液和H2B溶液,电离程度前者大于后者 | |
| B. | HB-的电离程度大于HB-的水解程度 | |
| C. | 该盐的电离方程式为AHB═A++H++B2- | |
| D. | 在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
9.下列有关分子晶体的说法中正确的是( )
| A. | 分子内均存在共价键 | B. | 分子间一定存在范德华力 | ||
| C. | 分子间一定存在氢键 | D. | 其结构一定为分子密堆积 |
16.下列说法正确的是( )
| A. | 蒸发时,应将蒸发皿中的溶液全部加热蒸干后停止加热 | |
| B. | 蒸馏实验开始时先通入冷凝水,再点燃酒精灯加热 | |
| C. | 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水的密度小 | |
| D. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口流出 |
13.用铝箔包着4.6g金属钠,放入足量水中,放出的H2体积(标准状况)是( )
| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
10. 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
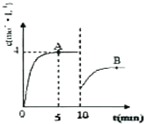
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.
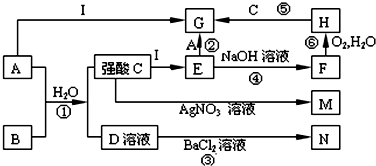
11.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g).半水煤气经过下列步骤转化为合成氨的原料.
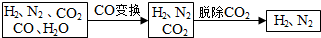
完成下列填空:
(1)半水煤气含有少量硫化氢.将半水煤气样品通入硝酸铅(或硫酸铜)溶液中(填写试剂名称),出现黑色沉淀,可以证明有硫化氢存在.
(2)半水煤气在铜催化下实现CO变换:CO+H2O$→_{△}^{Cu}$CO2+H2,若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=3:1.
(3)碱液吸收法是脱除二氧化碳的方法之一.已知:
若选择Na2CO3碱液作吸收液,其优点是价廉;缺点是吸收CO2能力差.如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?碱液循环使用写出这种方法涉及的化学反应方程式.2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O
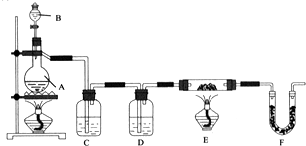
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案.取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数.
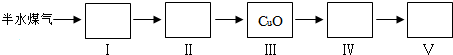
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中.
②该实验方案中,步骤IV(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数.
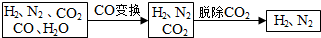
完成下列填空:
(1)半水煤气含有少量硫化氢.将半水煤气样品通入硝酸铅(或硫酸铜)溶液中(填写试剂名称),出现黑色沉淀,可以证明有硫化氢存在.
(2)半水煤气在铜催化下实现CO变换:CO+H2O$→_{△}^{Cu}$CO2+H2,若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=3:1.
(3)碱液吸收法是脱除二氧化碳的方法之一.已知:
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案.取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数.

①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中.
②该实验方案中,步骤IV(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数.