题目内容
18.X、Y、Z、R为短周期元素且原子序数依次增大.X、R 原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同,Z的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第15列•请冋答下列问題:(1)M基态原子的电子排布式是1s22s22p63s23p63d104s24p3
(2)上述5种元素电负性最大的是氧(填名称)X3Z+中Z原子的杂化方式为sp3
(3)R单质为面心立方最密堆积,则R单质的晶胞图为C,R的配位数是12
(4)MX3是强还原剂,可与AgN03溶液反应生成M2Z3和一种金厲单质,该反应的离子方程式是2Ag++2AsH3+3H2O=As2O3↓+12H++12Ag↓.
分析 X、Y、Z、R均为短周期元素且原子序数依次增大.Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同,原子核外电子排布为1s22s22p2,故Y为C元素;Z 的两种同素异形体都存在于大气中,对生命起着重要作用,则Z为O元素;X、R原子核外电子层数等于其最外层电子数,符合条件的元素有H、Be、Al,原子半径X<Y(C),故X为H元素,R的原子序数大于氧,故R为Al;M元素位于周期表的第4周期第15列,则M为As元素,以此解答该题.
解答 解:X、Y、Z、R均为短周期元素且原子序数依次增大.Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同,原子核外电子排布为1s22s22p2,故Y为C元素;Z 的两种同素异形体都存在于大气中,对生命起着重要作用,则Z为O元素;X、R原子核外电子层数等于其最外层电子数,符合条件的元素有H、Be、Al,原子半径X<Y(C),故X为H元素,R的原子序数大于氧,故R为Al;M元素位于周期表的第4周期第15列,则M为As元素,
(1)M为As元素,核外电子排布为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)上述5种元素中,O元素非金属性最强,故氧元素电负性最大,H3O+离子中O原子价层电子对数为3+$\frac{6-1-1×3}{2}$=4,则为sp3杂化,
故答案为:氧;sp3;
(3)R的单质为面心立方最密堆积,则R位于顶点和面上,晶胞图为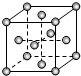 ,则C正确,以顶点原子研究,与之最近的原子处于面心,每个顶点R原子为12个面共用,故R的配位数是12,
,则C正确,以顶点原子研究,与之最近的原子处于面心,每个顶点R原子为12个面共用,故R的配位数是12,
故答案为:C;12;
(4)AsH3是强还原剂,可与AgN03溶液反应生成As2O3和一种金厲单质,应生成Ag,该反应的离子方程式是2Ag++2AsH3+3H2O=As2O3↓+12H++12Ag↓,
故答案为:2Ag++2AsH3+3H2O=As2O3↓+12H++12Ag↓.
点评 本题是对物质结构与性质的考查,为高考常见题型,侧重于学生的分析、计算能力的考查,涉及位置结构性质关系、价层电子对数互斥理论、核外电子排布、晶胞计算等,推断元素是解题关键,注意对基础知识的理解掌握.

| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A. | 分子内均存在共价键 | B. | 分子间一定存在范德华力 | ||
| C. | 分子间一定存在氢键 | D. | 其结构一定为分子密堆积 |
| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
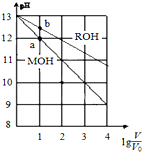 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
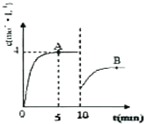
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.
| A. | 乙烯和乙烷 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 丙烯和丙烷 |