题目内容
2.已知水的摩尔质量M=18×10-3kg/mol,水的密度为1.0×103kg/m3,1mol水中含有6.0×1023个水分子,试估算水分子的质量和直径(结果保留一位有效数字)分析 水的摩尔质量M=18×10-3kg/mol,1mol水中含有6.0×1023个水分子,1mol水的质量为18g,1mol水分子个数为6.0×1023,水分子的质量=$\frac{M({H}_{2}O)}{{N}_{A}}$;
水的密度为1.0×103kg/m3,则1mL水的质量为1.0g,1mL水的物质的量=$\frac{1.0g}{18g/mol}$=$\frac{1}{18}$mol,水分子个数=$\frac{1}{18}$NA,则一个水分子体积=$\frac{1c{m}^{3}}{\frac{1}{18}{N}_{A}}$=$\frac{18}{{N}_{A}}$cm3,再结合球的体积计算分子直径.
解答 解:水的摩尔质量M=18×10-3kg/mol,1mol水中含有6.0×1023个水分子,1mol水的质量为18g,1mol水分子个数为6.0×1023,水分子的质量=$\frac{M({H}_{2}O)}{{N}_{A}}$=$\frac{18g/mol}{6.02×1{0}^{23}/mol}$=3.0×10-23g;
水的密度为1.0×103kg/m3,则1mL水的质量为1.0g,1mL水的物质的量=$\frac{1.0g}{18g/mol}$=$\frac{1}{18}$mol,水分子个数=$\frac{1}{18}$NA,则一个水分子体积=$\frac{1c{m}^{3}}{\frac{1}{18}{N}_{A}}$=$\frac{18}{{N}_{A}}$cm3=$\frac{4}{3}$π($\frac{D}{2}$)3,水分子直径=1.8×10-7 cm,
答:水分子的质量和直径分别为3.0×10-23g和1.8×10-7 cm.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系及单位换算是解本题关键,计算量较大,难度中等.

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
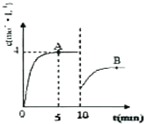
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.
| A. | pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 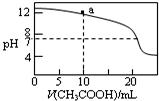 图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| A. | 乙烯和乙烷 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 丙烯和丙烷 |
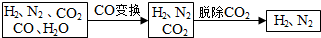
完成下列填空:
(1)半水煤气含有少量硫化氢.将半水煤气样品通入硝酸铅(或硫酸铜)溶液中(填写试剂名称),出现黑色沉淀,可以证明有硫化氢存在.
(2)半水煤气在铜催化下实现CO变换:CO+H2O$→_{△}^{Cu}$CO2+H2,若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=3:1.
(3)碱液吸收法是脱除二氧化碳的方法之一.已知:
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
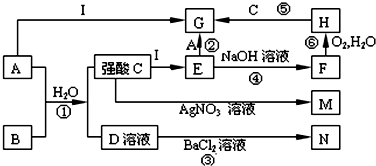
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案.取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数.
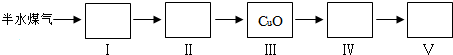
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中.
②该实验方案中,步骤IV(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数.
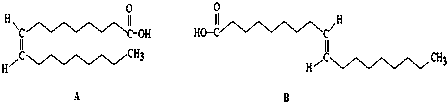
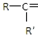 $\frac{\underline{\;氧化成\;}}{\;}$
$\frac{\underline{\;氧化成\;}}{\;}$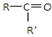 (R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
(R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.