题目内容
6.在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(1)写出醋酸的电离方程式:CH3COOH?CH3COO-+H+;当其物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(用a、b、c表示,下同)
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是b>a=c;
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序为c>a>b;
(4)当三者c(H+)相同且相同体积时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是c>a=b;
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则反应所需时间的由由大到小的顺序是a=b>c;
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是c>a=b.
分析 (1)醋酸是弱电解质,在溶液中部分电离,存在电离平衡,而HCl、硫酸均为强电解质,在溶液中完全电离,硫酸为二元酸,则硫酸溶液中氢离子浓度最大;
(2)同体积同物质的量浓度的三种酸,溶质物质的量相等,提供氢离子越多,中和NaOH的能力越大;
(3)HCl、醋酸为一元酸,而硫酸为二元酸,HCl、硫酸完全电离,醋酸电离程度不大;
(4)当三者c(H+)相同且相同体积时,盐酸、硫酸提供氢离子物质的量相等,醋酸是弱电解质,氢离子反应后,会促进醋酸电离继续产生氢离子;
(5)氢离子浓度影响反应速率,醋酸是弱电解质,氢离子反应后,会促进醋酸电离继续产生氢离子;
(6)HCl、硫酸均为强电解质,盐酸、硫酸溶液中氢离子物质的量相等,稀释相同倍数后氢离子仍相等;醋酸是弱电解质,学生相同倍数会促进醋酸电离继续产生氢离子,稀释后醋酸中氢离子浓度最大.
解答 解:(1)醋酸是弱电解质,在溶液中部分电离,存在电离平衡,电离方程式为:CH3COOH?CH3COO-+H+,而HCl、硫酸均为强电解质,在溶液中完全电离,盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度,硫酸为二元酸,则硫酸溶液中氢离子浓度最大,故c(H+)由大到小的顺序是:b>a>c,
故答案为:CH3COOH?CH3COO-+H+;b>a>c;
(2)同体积同物质的量浓度的三种酸,溶质物质的量相等,醋酸、HCl均为一元酸,二者提供氢离子物质的量相等,而硫酸为二元酸,提供氢离子物质的量最大,故中和NaOH的能力:b>a=c,
故答案为:b>a=c;
(3)HCl、醋酸为一元酸,而硫酸为二元酸,HCl、硫酸完全电离,醋酸为弱酸,电离程度不大,若三者c(H+)相同时,物质的量浓度由大到小的顺序为:c>a>b,
故答案为:c>a>b;
(4)当三者c(H+)相同且相同体积时,盐酸、硫酸提供氢离子物质的量相等,二者生成氢气相等,醋酸是弱电解质,氢离子反应后,会促进醋酸电离继续产生氢离子,醋酸反应生成氢气最多,故生成氢气:c>a=b,
故答案为:c>a=b;
(5)氢离子浓度影响反应速率,盐酸、硫酸中氢离子浓度相等,二者反应速率相等,生成等量氢气需要时间相等,醋酸是弱电解质,氢离子反应后,会促进醋酸电离继续产生氢离子,氢离子浓度相对较大,生成等量氢气需要时间最少,故所需时间:a=b>c,
故答案为:a=b>c;
(6)HCl、硫酸均为强电解质,盐酸、硫酸溶液中氢离子物质的量相等,稀释相同倍数后氢离子仍相等;醋酸是弱电解质,学生相同倍数会促进醋酸电离继续产生氢离子,稀释后醋酸中氢离子浓度最大,故:c>a=b,
故答案为:c>a=b.
点评 本题考查弱电解质电离、反应速率影响因素等,注意强弱电解质的比较,注重基础知识的积累.

| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
| A. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 达到平衡后,充入氦气,反应速率增大 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,增大A2(g)的浓度,B2的转化率增大 |
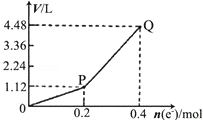
| A. | 电解过程中,溶液的pH不断增大 | |
| B. | Q点对应的气体中,H2与O2的体积比为2:1 | |
| C. | 阳极电极反应式为2H2O+4e-═4H++O2↑ | |
| D. | 当转移0.4mole-时,电解生成的铜为6.4g |
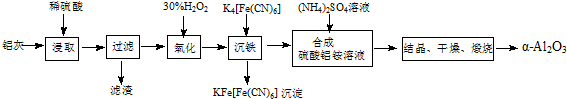
 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):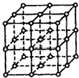 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.