题目内容
15.已知恒容条件下,反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的是( )| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 达到平衡后,充入氦气,反应速率增大 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,增大A2(g)的浓度,B2的转化率增大 |
分析 A.升高温度,正逆反应速率都增大;
B.达到平衡状态后,充入氦气,反应物和生成物浓度不变,不影响反应速率;
C.达到平衡状态后,增大压强平衡向气体体积减小的方向移动,升高温度平衡向吸热方向移动;
D.达到平衡后,增大一种反应物浓度,平衡正向移动.
解答 解:A.升高温度,增大活化分子百分数,所以正逆反应速率都增大,故A错误;
B.达到平衡状态后,充入氦气,反应物和生成物浓度不变,不影响反应速率,所以正逆反应速率不变,故B错误;
C.达到平衡状态后,增大压强平衡向气体体积减小的方向移动,升高温度平衡向吸热方向移动,该反应的正反应是反应前后气体体积减小的放热反应,升高温度平衡逆向移动、增大压强平衡正向移动,故C错误;
D.达到平衡后,增大一种反应物浓度,平衡正向移动,则另一种反应物的转化率会增大,所以达到平衡后,增大A2(g)的浓度,B2的转化率增大,故D正确;
故选D.
点评 本题考查化学反应速率影响因素、化学平衡影响因素,为高频考点,明确化学平衡移动原理及化学反应速率影响原理是解本题关键,注意:升高温度能增大所有的化学反应速率,与反应热无关,易错选项是B.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
5.下列说法正确的是( )
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
11.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氨水与稀盐酸反应:H++OH-═H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
12.下列离子方程式书写正确的是( )
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
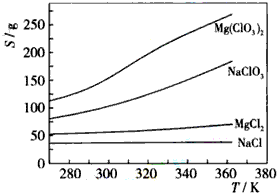 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.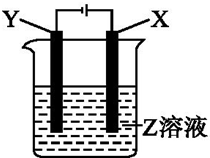 根据如图所示装置回答:
根据如图所示装置回答: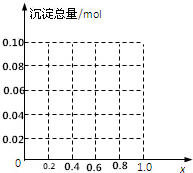 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.