题目内容
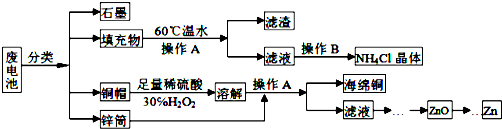
17.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下: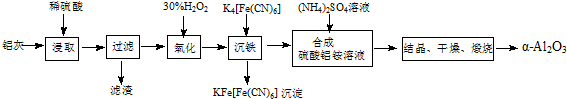
(1)铝灰中氧化铝与硫酸反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O.
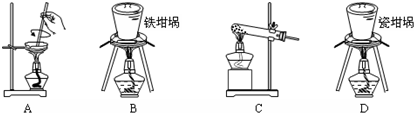
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为B(填选项编号).
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数为2.5×10-5.
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O]═2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置.
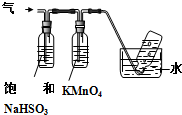
①集气瓶中收集到的气体是N2.(填化学式)
②KMnO4溶液褪色,发生的离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
分析 铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α-Al2O3;
(1)氧化铝和稀硫酸反应生成硫酸铝和水;
(2)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧;
(3)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子;
(4)铁离子和铁氰化钾反应产生沉淀;
(5)该反应的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$;
(6)①煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O]═2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,混合气体通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的气体采用排水法收集;
②二氧化硫被酸性高锰酸钾溶液氧化而导致KMnO4溶液褪色,二者发生氧化还原反应生成锰离子、硫酸根离子和氢离子.
解答 解:铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α-Al2O3;
(1)氧化铝属于两性氧化物,能溶于强酸和强碱溶液,氧化铝和稀硫酸反应生成硫酸铝和水,反应方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B;
(3)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有,
故答案为:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$,反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{1{0}^{-42}}{c(F{e}^{3+}).{c}^{3}(O{H}^{-})}$=2.5×10-5,故答案为:2.5×10-5;
(6)①煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O]═2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,混合气体通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的气体N2 采用排水法收集,故答案为:N2;
②二氧化硫被酸性高锰酸钾溶液氧化而导致KMnO4溶液褪色,二者发生氧化还原反应生成锰离子、硫酸根离子和氢离子,离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
点评 本题以氧化铝提取工艺流程为载体,考查元素化合物性质及相互转化、氧化还原、离子方程式、实验基本操作等知识点,注意把握制备原理、把握物质的性质以及相关反应方程式的书写,难点是离子方程式的书写及平衡常数计算.

 名校课堂系列答案
名校课堂系列答案| A. | 2.7g | B. | 8.1g | C. | 5.4g | D. | 10.8g |
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
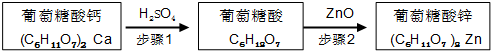
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(1)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(2)下列物质可替代ZnO的是b、e(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4e.ZnCO3.
Ⅱ.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题:(3)第①步中溴水氧化葡萄糖可以用如图装置,其中水浴加热的原因是溶液受热均匀,且便于控制温度
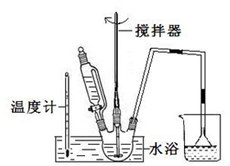
(4)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
(5)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(6)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
| A. | BaCl2溶液 | B. | FeCl2溶液 | C. | FeCl3溶液 | D. | Fe(NO3)2溶液 |
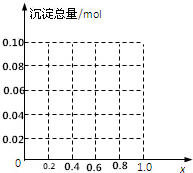 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.