题目内容
3.用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况),下列判断正确的是( )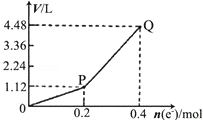
| A. | 电解过程中,溶液的pH不断增大 | |
| B. | Q点对应的气体中,H2与O2的体积比为2:1 | |
| C. | 阳极电极反应式为2H2O+4e-═4H++O2↑ | |
| D. | 当转移0.4mole-时,电解生成的铜为6.4g |
分析 惰性电极电解一定量的硫酸铜溶液,开始时阳极上析出O2、阴极上析出Cu,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,如果只有阳极析出气体,则转移电子和生成氢气体积关系应该成正比,为一条直线,结合图2可知,0-P为直线、P-Q为直线,且二者斜率不同,说明P-Q时阴极上析出氢气,则P-Q发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,0-P收集的气体是O2,P到Q点时收集到的混合气体为H2和O2,
A.电解过程中,0-P段发生反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,溶液酸性增强;
B.Q点收集的气体是H2和O2,P点1.12L为O2,PQ段3.36L气体中,由电解水反应可知0.2mol电子通过时生成0.1mol H2、0.05mol O2,体积比为2:1;
C.电解时阳极上失电子发生氧化反应;
D.根据以上分析知,当转移电子0.2mol时铜完全析出,析出n(Cu)=$\frac{0.2mol}{2}$=0.1mol,根据m=nM计算析出Cu的质量.
解答 解:惰性电极电解一定量的硫酸铜溶液,开始时阳极上析出O2、阴极上析出Cu,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,如果只有阳极析出气体,则转移电子和生成氢气体积关系应该成正比,为一条直线,结合图2可知,0-P为直线、P-Q为直线,且二者斜率不同,说明P-Q时阴极上析出氢气,则P-Q发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,0-P收集的气体是O2,P到Q点时收集到的混合气体为H2和O2,
A.电解过程中,0-P段发生反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,电解过程中有硫酸生成,导致溶液酸性增强,溶液的pH减小,故A错误;
B.Q点收集的气体是H2和O2,P点1.12L为O2,PQ段3.36L气体中,由电解水反应可知0.2mol电子通过时生成0.1mol H2、0.05mol O2,体积比为2:1,Q点收集到的气体中H2和O2体积比为1:1,故B错误;
C.电解时阳极上失电子发生氧化反应,电极反应式为2H2O-4e-=4H++O2↑,故C错误;
D.根据以上分析知,当转移电子0.2mol时铜完全析出,析出n(Cu)=$\frac{0.2mol}{2}$=0.1mol,m(Cu)=nM=0.1mol×64g/mol=6.4g,故D正确;
故选D.
点评 本题以电解原理为载体考查化学方程式的计算,为高频考点,明确各个电极上析出物质成分是解本题关键,明确图中拐点含义,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氨水与稀盐酸反应:H++OH-═H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 验证氯气能否与水反应的实验时,用氢氧化钠溶液处理尾气 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.