题目内容
12.有一瓶澄清溶液,其中可能含有Mg2+,Na+,Ba2+,Fe3+,Cl-,HCO3-,Al3+、SO42-等离子,取该溶液进行以下实验(1)用pH试纸检验溶液,呈强酸性.
(2)另取少量溶液于试管中,向其中逐滴加入氢氧化钠溶液,使溶液从酸性逐渐变成碱性,在整个过程中均无沉淀生成.
(3)取部分上述碱性溶液,加入氯化钡溶液,有白色沉淀生成.
根据以上实验确定:该溶液中肯定存在的离子是H+、SO42-;可能存在的离子是Na+、Cl-.
分析 (1)用pH试纸检验溶液,呈强酸性,则溶液中一定存在H+,一定不存在HCO3-;
(2)另取少量溶液于试管中,向其中逐滴加入氢氧化钠溶液,使溶液从酸性逐渐变成碱性,在整个过程中均无沉淀生成,则溶液中一定不存在Mg2+、Fe3+;
(3)取部分上述碱性溶液,加入氯化钡溶液,有白色沉淀生成,则溶液中一定存在SO42-,则一定不存在Ba2+,据此进行解答.
解答 解:根据(1)可知溶液中一定存在H+,一定不存在HCO3-;根据(2)可知溶液中一定不存在Mg2+、Fe3+;根据(3)可知溶液中一定存在SO42-,则一定不存在Ba2+,
根据分析可知,溶液中一定存在的离子为:H+、SO42-,可能存在的离子为:Na+、Cl-,
故答案为:H+、SO42-;Na+、Cl-.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.下列有关化学用语表示正确的是( )
| A. | Cl-的结构示意图: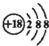 | |
| B. | NaClO的电子式: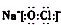 | |
| C. | 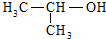 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$ I |
1.某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1.则下列叙述正确的有( )
①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1.则下列叙述正确的有( )
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 平衡时气体平均相对分子质量约为23.3 | |
| D. | 其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
17.如图:X为铝片,Y为镁条,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( )
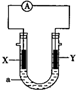

| A. | X为负极,电极反应为:Al-3e-═Al3+ | |
| B. | X为正极,电极反应为:2H2O+O2+4e-═4OH- | |
| C. | Y为负极,电极反应为:Mg-2e-═Mg2+ | |
| D. | Y为正极,电极反应为:2H2O+2e-═2OH-+H2↑ |