题目内容
8.Cr2O3常用作建筑材料的着色剂.有碳素铬铁合金粉制取Cr2O3的流程图如图所示: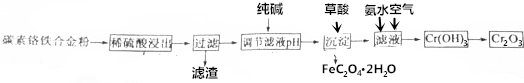
已知:金属Cr与稀硫酸反应生成Cr2+.
回答下列问题:
(1)在稀硫酸浸出时铁发生反应的离子方程式为Fe+2H+=Fe2++H2↑,浸出过程中会有少量的PH3、H2S等还原性气体生成,可用高锰酸钾溶液吸收,已知PH3与高锰酸钾溶液反应生成Mn2O3、K2HPO3、KH2PO3、H2O,写出该反应的化学方程式:4PH3+6KMnO4=3Mn2O3+2K2HPO3+2KH2PO3+3H2O.
(2)加纯碱调溶液pH=3.0,保持一定酸性的目的是防止Cr2+、Fe2+水解.
(3)加草酸的目的是除去Fe3+,写出反应的离子方程式:H2C2O4+2Fe3+=2Fe2++2CO2↑+2H+.
(4)常温下Ksp(FeC2O4)=3.2×10-7,则常温下FeC2O4溶解度约为4.608×10-6g/100gH2O.
(5)生成Cr(OH)3后的溶液中存在两种主要副产物,其化学式为(NH4)2SO4、(NH4)2C2O4.
(6)Cr2O3与Al2O3的性质相似,写出Cr2O3与氢氧化钠溶液反应的化学方程式Cr2O3+2NaOH=2NaCrO2+H2O.
分析 碳素铬铁合金粉加入稀硫酸生成Cr2+、Fe2+,过滤除去滤渣,滤液中含有Cr2+、Fe2+,加入纯碱消耗一定量的硫酸,达到调节pH的目的,加入操作可生成FeC2O4晶体,滤液通入空气,加入氨水可生成Cr(OH)3,加热分解可生成Cr2O3,
(1)铁与稀硫酸反应生成硫酸亚铁,PH3与高锰酸钾溶液反应生成Mn2O3、K2HPO3、KH2PO3、H2O,结合质量守恒书写化学方程式;
(2)为防止金属离子Cr2+、Fe2+水解,可保持溶液呈酸性;
(3)草酸具有还原性,可与铁离子发生氧化还原反应;
(4)常温下Ksp(FeC2O4)=3.2×10-7,计算1L水中含有FeC2O4的质量,可计算溶解度;
(5)氯气中含有硫酸根离子、草酸根离子,生成Cr(OH)3后的溶液中存在两种主要副产物,为硫酸铵、草酸铵等;
(6)Cr2O3与Al2O3的性质相似,结合氧化铝的性质书写方程式.
解答 解:碳素铬铁合金粉加入稀硫酸生成Cr2+、Fe2+,过滤除去滤渣,滤液中含有Cr2+、Fe2+,加入纯碱消耗一定量的硫酸,达到调节pH的目的,加入操作可生成FeC2O4晶体,滤液通入空气,加入氨水可生成Cr(OH)3,加热分解可生成Cr2O3,
(1)铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,PH3与高锰酸钾溶液反应生成Mn2O3、K2HPO3、KH2PO3、H2O,反应的化学方程式为4PH3+6KMnO4=3Mn2O3+2K2HPO3+2KH2PO3+3H2O,
故答案为:Fe+2H+=Fe2++H2↑;4PH3+6KMnO4=3Mn2O3+2K2HPO3+2KH2PO3+3H2O;
(2)为防止金属离子Cr2+、Fe2+水解,可保持溶液呈酸性,故答案为:防止Cr2+、Fe2+水解;
(3)草酸具有还原性,可与铁离子发生氧化还原反应,反应的离子方程式为H2C2O4+2Fe3+=2Fe2++2CO2↑+2H+,故答案为:H2C2O4+2Fe3+=2Fe2++2CO2↑+2H+;
(4)常温下Ksp(FeC2O4)=3.2×10-7,可知1L水中含有3.2×10-7molFeC2O4,质量为144g/mol×3.2×10-7mol=4.608×10-5g,则常温下FeC2O4溶解度约为4.608×10-6g,故答案为:4.608×10-6;
(5)氯气中含有硫酸根离子、草酸根离子,生成Cr(OH)3后的溶液中存在两种主要副产物,为硫酸铵、草酸铵等,其化学式为(NH4)2SO4、(NH4)2C2O4,
故答案为:(NH4)2SO4、(NH4)2C2O4;
(6)Cr2O3与Al2O3的性质相似,则Cr2O3与氢氧化钠溶液反应的化学方程式为Cr2O3+2NaOH=2NaCrO2+H2O,
故答案为:Cr2O3+2NaOH=2NaCrO2+H2O.
点评 本题考查物质的分离、提纯的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,本题注重溶解度的计算、离子的检验、氧化还原反应等知识点,难度不大,离子的检验是高考的热点.

 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
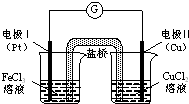
| A. | 电极Ⅰ上发生还原反应,作原电池的正极 | |
| B. | 电极Ⅱ的电极反应式为:Cu-2e-═Cu2+ | |
| C. | 该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
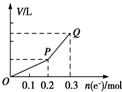 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.1mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.1mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |

根据以上规律判断,下列结论正确的是( )
| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反应Ⅱ:△H>0,T1>T2 | D. | 反应Ⅳ:△H<0,T2>T1 |

图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
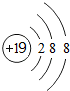
(l)写出钾离子的结构示意图
 .
.(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(选填下列字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是过滤(填写实验操作名称).图2中符合该晶体溶解度曲线的是M(填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
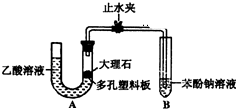 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去). -ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)
-ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)