题目内容
19.实验室用MnO2粉末与浓盐酸共热制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:

(1)从下图选择适合A处的装置②(填序号).
(2)装置B中能否观察到预期的实验现象?不能(填“能”或“不能”),请说明理由进入B装置的氯气中混有水蒸气.
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol?L-1的NaOH溶液,配制过程如下:
①称量4.0gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却.
②将烧杯中的溶液转移至100mL容量瓶中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中.
③继续加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹槽面最低处与刻度线相切.
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签.
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL.
(3)完成步骤一的空格.
(4)根据实验数据,计算反应后A中残余盐酸的浓度为5.90mol?L-1.
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,价2.00mol?L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是残余溶液中,n(Cl-)>n(H+).
分析 (1)依据反应物状态和反应条件选择发生装置;
(2)依据氯气不具有漂白性,次氯酸具有漂白性,结合从A中出来的气体的成分解答;
(3)实验II①依据m=CVM计算需要溶质的质量;
②配制溶液的应在容量瓶中配制,依据配制溶液体积选择合适规格的容量瓶;
③依据定容的正确操作解答;
(4)溶液具有均一性,依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)计算盐酸的物质的量浓度;
(5)依据MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知反应后溶液中剩余物为盐酸和氯化锰,n(Cl-)>n(H+),据此解答.
解答 解:(1)MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应物为固体和液体,反应条件为加热,所以应选择装置②,故答案为:②;
(2)氯气不具有漂白性,次氯酸具有漂白性,从A中出来的气体汉阳水蒸气,能够与氯气反应生成次氯酸,所以B和C中布条都褪色;
故答案为:不能;进入B装置的氯气中混有水蒸气;
(3)实验II①配制100mL1.00mol?L-1的NaOH溶液,需要氢氧化钠的质量m=1.00mol/L×0.1L×40g/mol=4.0g;
故答案为:4.0;
②配制100mL1.00mol?L-1的NaOH溶液,需要选择100mL容量瓶;
故答案为:100mL容量瓶;
③定容时,继续加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹槽面最低处与刻度线相切;
故答案为:胶头滴管;
(4)设反应后剩余盐酸的物质的量浓度为C,则依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)得11.80mL×1.00mol/L=2.00mL×C,解得C=5.90mol/L,
故答案为:5.90;
(5)依据MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知反应后溶液中剩余物为盐酸和氯化锰,n(Cl-)>n(H+),所以通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加2.00mol?L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL;
故答案为:残余溶液中,n(Cl-)>n(H+).
点评 本题考查了氯气的实验室制备方法和氯气的性质检验,以及配制一定物质的量浓度溶液,明确氯气制备原理及性质、熟悉配制一定物质的量浓度溶液的一般步骤即可解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |

图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
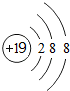
(l)写出钾离子的结构示意图
 .
.(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(选填下列字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是过滤(填写实验操作名称).图2中符合该晶体溶解度曲线的是M(填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧横线上的产物是OH- | |
| C. | 10molH+参加反应时,电子转移5mol | |
| D. | 该反应的氧化剂为KMnO4 |
| A. | Cu | B. | Mg | C. | Fe | D. | Al |
| A. | O2 | B. | 酸雨 | C. | 石油 | D. | 含磷洗涤剂 |
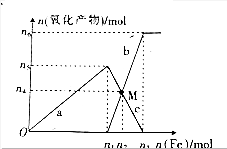 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.