题目内容
下列有关实验原理或操作正确的是( )
A、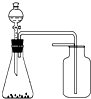 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、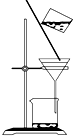 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.根据一氧化氮能够与空气中的氧气反应生成二氧化氮分析;
B.洗涤时不能用玻璃棒搅拌;
C.先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸;
D.广泛pH试纸读数只能是整数.
B.洗涤时不能用玻璃棒搅拌;
C.先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸;
D.广泛pH试纸读数只能是整数.
解答:
解:A.由于一氧化氮能够与空气中的氧气反应生成二氧化氮,所以不能够使用排空气法制取一氧化氮,故A错误;
B.洗涤时不能用玻璃棒搅拌,否则易损坏滤纸而过滤失败,故B错误;
C.制备乙酸乙酯时,先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸,故C正确;
D.广泛pH试纸测定溶液的酸碱性,读数只能是整数,不可能是5.2,故D错误.
故选C.
B.洗涤时不能用玻璃棒搅拌,否则易损坏滤纸而过滤失败,故B错误;
C.制备乙酸乙酯时,先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸,故C正确;
D.广泛pH试纸测定溶液的酸碱性,读数只能是整数,不可能是5.2,故D错误.
故选C.
点评:本题考查了pH的测定、过滤、除杂及反应装置的选取等知识,难度不大,侧重实验操作及实验基本技能的考查,可以根据所学知识完成.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列说法正确的是( )
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
下列判断中,正确的是( )
| A、可用NaOH溶液除去乙酸乙酯中混有的少量乙酸和乙醇 |
| B、可用水区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
| C、淀粉水解的最终产物能与新制的氢氧化铜悬浊液反应生成砖红色的沉淀 |
| D、蒸馏“地沟油”可以获得甘油 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b<80y(1-
|
下列关于铜的说法正确的是( )
| A、铜在干燥的空气中和在潮湿的空气中存在的形态相同 |
| B、相同质量的铜分别与足量的氯气、硫完全反应,失去的电子数相同 |
| C、相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的量相同 |
| D、相同质量的铜分别与足量的稀硝酸、浓硝酸完全反应,生成气体的物质的量不同 |
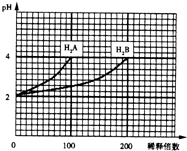 常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A、H2A为二元弱酸 |
| B、PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) |
| D、Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
下列叙述错误的是( )
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |