题目内容
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b<80y(1-
|
考点:铜金属及其重要化合物的主要性质,硝酸的化学性质,铁的化学性质
专题:几种重要的金属及其化合物
分析:A.溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能溶解;
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度,据此判断;
D.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同.
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度,据此判断;
D.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同.
解答:
解:A.铁铜合金与硝酸反应除生成NO外,还要生成相应的硝酸铁、硝酸铜等盐,即溶液中存在NO
,当在其中加入H2SO4时,H+和NO
可继续氧化剩余的金属,故A正确;
B.因Fe3+也可以氧化Cu而被还原为Fe2+,因此当金属全部溶解时也可能只有Fe2+、Cu2+,故B错误;
C.因没有告诉溶液中所含的铁离子是Fe2+、Fe3+,还是两者都有,故无法计算b,故C错误;
D.根据铁和铜与硝酸的反应,作酸性的硝酸在Fe(NO3)3和Cu(NO3)2中,为3y(1-a)+2yamol,作氧化性的硝酸,得到的电子等于Fe、Cu失去的电子,由于NO是唯一的还原产物,所以作氧化性的硝酸为
mol,所有硝酸的总量为=
=4y(1-
),c(HNO3)═
=80y(1-
),因为硝酸还可能有剩余,所以b≥80y(1-
),故D错误.
故选A.
- 3 |
- 3 |
B.因Fe3+也可以氧化Cu而被还原为Fe2+,因此当金属全部溶解时也可能只有Fe2+、Cu2+,故B错误;
C.因没有告诉溶液中所含的铁离子是Fe2+、Fe3+,还是两者都有,故无法计算b,故C错误;
D.根据铁和铜与硝酸的反应,作酸性的硝酸在Fe(NO3)3和Cu(NO3)2中,为3y(1-a)+2yamol,作氧化性的硝酸,得到的电子等于Fe、Cu失去的电子,由于NO是唯一的还原产物,所以作氧化性的硝酸为
| 3y(1-a)+2ya |
| 3 |
| 4[3y(1-a)+2ya] |
| 3 |
| a |
| 3 |
4y(1-
| ||
| 0.05L |
| a |
| 3 |
| a |
| 3 |
故选A.
点评:本题考查氧化还原反应的计算,题目难度中等,注意物质氧化性、还原性的比较,结合质量守恒和得失电子守恒计算.

练习册系列答案
相关题目
有关有机物的说法正确的是( )
| A、石油分馏可以获得重要的有机化工原料乙烯 |
| B、乙醇、乙酸、乙酸乙酯可用饱和氢氧化钠溶液鉴别 |
| C、乙烷和苯所含的碳碳键不同,但都能发生氧化反应和取代反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
下列有关实验原理或操作正确的是( )
A、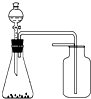 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、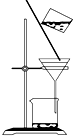 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
下列物质在一定条件下,可与CH4发生取代反应的是( )
| A、氧气 |
| B、溴水 |
| C、氯气 |
| D、酸性KMnO4溶液 |
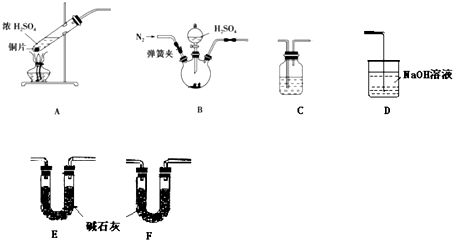
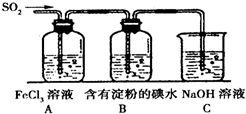 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图: