题目内容
回答下列问题
(1)R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;(填写元素符号)
(2)X原子在第二能层上只有一个空轨道,则X是 ;(填写元素符号)
(3)Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,是属于 区的元素.
(1)R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)X原子在第二能层上只有一个空轨道,则X是
(3)Y原子的核电荷数为33,其外围电子排布是
考点:原子核外电子排布
专题:原子组成与结构专题
分析:(1)R原子的3p轨道上只有一个未成对电子,则R原子3p轨道上可能含有1个电子或5个电子,据此判断R元素;
(2)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
(3)Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理书写其外围电子排布式,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,根据最后排入的电子判断该元素所属区域.
(2)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
(3)Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理书写其外围电子排布式,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,根据最后排入的电子判断该元素所属区域.
解答:
解:(1)R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素,
故答案为:Al;Cl;
(2)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素,
故答案为:C;
(3)Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理知其外围电子排布式4s24p3,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,所以As元素位于第四周期第VA族,该元素最后排入的电子是p电子,所以As位于p区,
故答案为:4s24p3;第四周期第VA族;p.
故答案为:Al;Cl;
(2)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素,
故答案为:C;
(3)Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理知其外围电子排布式4s24p3,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,所以As元素位于第四周期第VA族,该元素最后排入的电子是p电子,所以As位于p区,
故答案为:4s24p3;第四周期第VA族;p.
点评:本题考查了原子核外电子排布,明确原子结构、元素周期表结构再结合构造原理来分析解答,知道元素周期表所属区域、元素在周期表中的位置等知识点是解本题关键,题目难度中等.

练习册系列答案
相关题目
在下列所示的微粒中,氧化性最强的是( )
| A、1S22S22P2 |
| B、1S22S22P5 |
| C、1S22S22P63S1 |
| D、1S22S22P6 |
在核外电子排布如下的原子中,有最高化合价且其值最大的是( )
| A、1S22S22P2 |
| B、1S22S22P63S23P6 |
| C、1S22S22P5 |
| D、1S22S22P63S23P1 |
下列说法正确的是( )
| A、基态原子第四电子层只有2个电子,则该原子第三电子层的电子数肯定为8或18个 | ||
| B、Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | ||
C、R为第二周期元素,其原子具有的电子层数为最外层电子数的
| ||
| D、核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 |
下列有关实验原理或操作正确的是( )
A、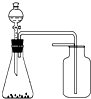 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、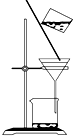 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |