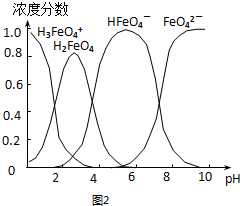
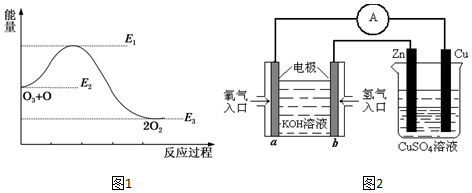
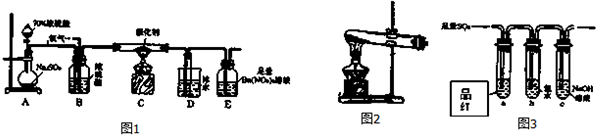
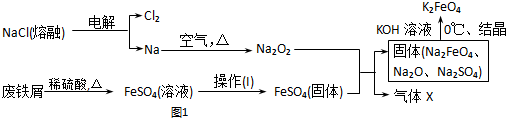题目内容
3.下列有关化学用语表示正确的是( )| A. | 氧化钠的电子式: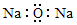 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: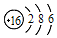 | |
| D. | CCl4的球棍模型: |
分析 A.氧化钠为离子化合物,阴阳离子都需要标出所带电荷;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
D. 为比例模型,且氯原子的原子半径应该大于碳原子.
为比例模型,且氯原子的原子半径应该大于碳原子.
解答 解:A.氧化钠是离子化合物,由钠离子与氧离子构成,其正确的电子式为 ,故A错误;
,故A错误;
B.质子数为35、中子数为45的溴原子的质量数=45+35=80,该原子可以表示为:${\;}_{35}^{80}$Br,故B正确;
C.硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故C错误;
,故C错误;
D.四氯化碳分子中,氯原子的原子半径大于碳原子,其正确的球棍模型为: ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及比例模型与球棍模型、离子结构示意图、元素符号、电子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | 生物质能来深于植物及其加工产品所贮存的能量,直接燃烧是利用方式之一 | |
| B. | 石油的裂化与裂解都是化学变化,而煤的气化与液化是物理变化 | |
| C. | 用高压氢气、氧气制作燃料电池是氢能源利用的一种重要方式 | |
| D. | 化学反应过程中反应物的总能量小于生成物的总能量,往往伴随热量的吸收 |
11.下列实验操作中正确的是( )
| A. | 配制450mL溶液需要用到450mL容量瓶 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上 | |
| D. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口 |
15.X、Y、Z、W均为短周期主族元素,且原子序数逐渐增大.已知:
①X、Y、W分别位于不同周期;
②Z和W属于同一主族,且W的原子序数是Z的两倍;
③Y、Z、W的最外层电子数之和为17.
下列说法不正确的是( )
①X、Y、W分别位于不同周期;
②Z和W属于同一主族,且W的原子序数是Z的两倍;
③Y、Z、W的最外层电子数之和为17.
下列说法不正确的是( )
| A. | 原子半径由小到大的顺序为r(X)<r(Y)<r(Z)<r(W) | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | Z分别能与X、Y和W形成多种化合物 | |
| D. | 与单质W比较,单质Z更容易与单质X化合 |
9.加热N2O5依次发生的分解反应为:①N2O5?N2O3+O2,②N2O3?N2O+O2;在2L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |