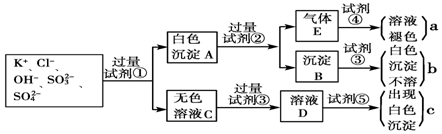
题目内容
11.下列实验操作中正确的是( )| A. | 配制450mL溶液需要用到450mL容量瓶 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上 | |
| D. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口 |
分析 A.配制一定物质的量浓度溶液时,选取的容量瓶规格应该等于或稍微大于配制溶液体积;
B.萃取剂不能和原溶剂互溶;
C.NaOH易潮解且具有强腐蚀性,不能放置在纸上称量;
D.蒸馏时,温度计测量馏分温度.
解答 解:A.配制一定物质的量浓度溶液时,选取的容量瓶规格应该等于或稍微大于配制溶液体积,实验室没有450mL容量瓶,但有500mL容量瓶,应该选取500mL容量瓶,故A错误;
B.萃取剂不能和原溶剂互溶,乙醇和水互溶,不能作碘水的萃取剂,应该用苯或四氯化碳作碘水的萃取剂,故B错误;
C.NaOH易潮解且具有强腐蚀性,不能放置在纸上称量,所以称量NaOH固体时应该放置在烧杯中,故C错误;
D.蒸馏时,温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器选取、萃取剂的选取、实验操作等知识点,明确仪器用途、实验操作方法及实验原理是解本题关键,注意容量瓶、量筒的选取方法及蒸馏时温度计的放置位置,为易错点.

练习册系列答案
相关题目
2.用98%、密度为1.84g/cm3的浓H2SO4配制l mol/L的稀硫酸100mL,现给出下列可能用到仪器:
①100mL量筒;
②10mL量筒;
③50mL烧杯;
④托盘天平;
⑤100mL容量瓶;
⑥胶头滴管;
⑦玻璃棒
按使用仪器先后顺序排列正确的是( )
①100mL量筒;
②10mL量筒;
③50mL烧杯;
④托盘天平;
⑤100mL容量瓶;
⑥胶头滴管;
⑦玻璃棒
按使用仪器先后顺序排列正确的是( )
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦ |
16.下列水处理剂的工作原理与胶体有关的是( )
| A. | 活性炭 | B. | 氯气 | C. | 明矾 | D. | 次氯酸钠 |
3.下列有关化学用语表示正确的是( )
| A. | 氧化钠的电子式: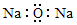 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: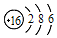 | |
| D. | CCl4的球棍模型: |
20.将1mol•L-1NaOH溶液与3mol•L-1NaOH溶液等体积混合,此溶液的物质的量浓度是( )
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
18.实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
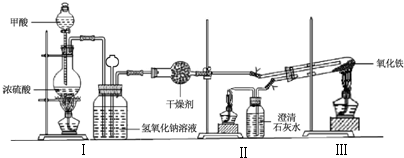
①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH$→_{加热}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为III、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种种可能.
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)

①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH$→_{加热}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为III、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)