题目内容
18.镇痛剂M(苯佐卡因)结构简式如图,下列说法正确的是( )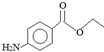
| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
分析 A.该有机物分子中含有9个碳原子;
B.1molM分子中含有1mol酯基,1mol酯基水解消耗1mol氢氧化钠溶液;
C.该有机物分子中含有氨基,氨基与盐酸发生化合反应;
D.与M含有相同官能团的同分异构体,则满足条件的有机物分子中含有氨基和酯基,结合同分异构体的书写原则判断.
解答 解:A.M分子中含有9个C,其正确的分子式为:C9H11NO2,故A错误;
B.1mol 中含有1mol酯基,与氢氧化钠溶液反应时能够消耗1molNaOH溶液,故B正确;
中含有1mol酯基,与氢氧化钠溶液反应时能够消耗1molNaOH溶液,故B正确;
C. 分子中含有氨基,则M在溶液中呈碱性,能够与盐酸发生化合反应,不是取代反应,故C错误;
分子中含有氨基,则M在溶液中呈碱性,能够与盐酸发生化合反应,不是取代反应,故C错误;
D.-C3H5O2基团且是酯基的结构有:-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,它们与氨基都有互为邻、间、对三种位置关系,则有含有氨基和的-C3H5O2的有机物有18种结构,另外其侧链可以含有3个取代基,所以与M含有相同官能团的同分异构体数目大于18种,故D错误;
故选B.
点评 本题考查了有机物结构与性质,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握常见有机物官能团与性质的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z.下列叙述正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)△H=-907.2kJ•mol-1K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
①4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)△H=-907.2kJ•mol-1K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
13.已知分子式为C9H12的苯的同系物,苯环上只含有一个取代基,则其与氢气完全加成后的产物,在一定条件下与溴发生取到反应,生成的一溴代物共有(不考虑立体异构)( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
3.铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30%H2SO4,下图是处于工作状态的铅蓄电池示意图,若两电极的质量增加且a极增加得更多.下列说法正确的是( )

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
6.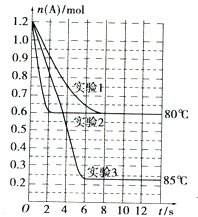 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
7.下列离子在溶液中能大量共存的是( )
| A. | Al3+、NO3-、OH-、Cl- | B. | H+、Ba2+、Ag+、Cl- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Ca2+、H+、Cl-、CO32- |
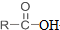 +SOCl2→
+SOCl2→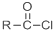 +SO2+HCl
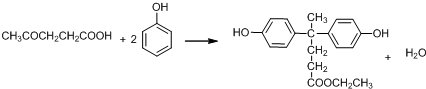
+SO2+HCl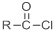 +R′OH→
+R′OH→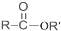 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)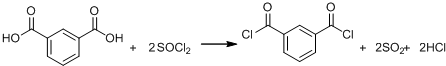 .
. .
. 结构.
结构.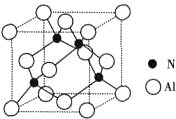 由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.