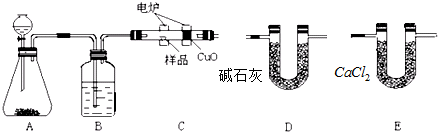
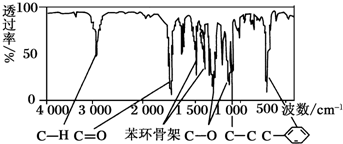
题目内容
15.请将下列物质As2S3、H2SO4、HNO3、NO、H3AsO4、H2O组成一个自发的氧化还原反应,并配平,用单线桥标明电子转移情况.分析 As2S3具有还原性,HNO3具有氧化性,二者发生氧化还原反应生成H2SO4、NO、H3AsO4,其反应方程式为3As2S3+28HNO3+4H2O=9H2SO4+28NO↑+6H3AsO4,根据化合价的变化计算转移电子数.
解答 解:As2S3具有还原性,HNO3具有氧化性,二者发生氧化还原反应生成H2SO4、NO、H3AsO4,其反应方程式为3As2S3+28HNO3+4H2O=9H2SO4+28NO↑+6H3AsO4,反应中As元素化合价由+3价变为+5价、S元素化合价由-2价变为+6价,HNO3中N元素的化合价由+5变为+2,则反应转移电子数为84,用单线桥标明电子转移为: ;
;
故答案为: .
.
点评 本题考查了氧化还原反应,涉及了氧化还原反应的配平、氧化剂、氧化产物的判断及分析电子转移的方向和数目,题目难度中等,转移掌握氧化还原反应的实质及配平方法,能够利用单线桥分析电子转移的分析和数目.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度( )
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
10.已知25℃、101kPa下,石墨,CO(g)燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1
则a、b、c的关系正确的是( )
C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1
则a、b、c的关系正确的是( )
| A. | a=b+c | B. | a=b-c | C. | a=c-b | D. | c=a+b |
7.下列电子式书写正确的是( )
| A. | Ca2+[:$\underset{\stackrel{••}{Cl}}{••}$:]2- | B. | Na+[$\stackrel{•}{X}$$\underset{\stackrel{••}{S}}{••}$$\stackrel{•}{X}$]-2Na+ | ||
| C. | [Mg2+][$\underset{X}{•}$$\underset{\stackrel{••}{O}}{••}$$\underset{X}{•}$]2- | D. | K+[$\stackrel{•}{X}$$\underset{\stackrel{••}{F}}{••}$:]- |
 HCl
HCl .
.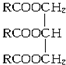 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.