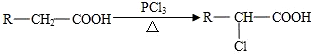
题目内容
10.已知25℃、101kPa下,石墨,CO(g)燃烧的热化学方程式分别为:C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1
则a、b、c的关系正确的是( )
| A. | a=b+c | B. | a=b-c | C. | a=c-b | D. | c=a+b |
分析 ①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1,②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1,利用盖斯定律①+②可得③C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1,反应热与化学计量数成正比,据此分析a、b、c的关系.
解答 解:①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1,②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1,利用盖斯定律①+②可得③C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1,反应热与化学计量数成正比,则-c+(-b)=(-a),即a=b+c,
故选A.
点评 本题考查了热化学方程式和盖斯定律的计算应用,明确热化学方程式意义、盖斯定律的应用即可解答,题目较简单,注意反应热的符号,为易错点.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
20.羧酸分子里的官能团是( )
| A. |  | B. |  | C. |  | D. | -CnHn+1 |
18.己知:KI溶液在酸性条件下能被空气中的O2氧化,反应的离子方程式为:O2+4I-+4H+═2I2+2H2O.
(I)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、1mol/L KOH溶液、淀粉溶液)
(2)在上述实验中,三种溶液混合的顺序最合理的是C(选填下列选项);应记录的内容溶液从无色变为蓝色所需的时间.
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
(限选试剂:1mol/L盐酸、1mol/L KOH溶液、碘水、淀粉溶液)
(I)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、1mol/L KOH溶液、淀粉溶液)
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
5.固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4中的若干种,为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图:
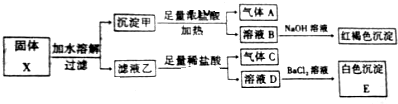
根据上述实验,下列说法中正确的是( )

根据上述实验,下列说法中正确的是( )
| A. | 固体X中一定含有Fe2O3 | B. | 沉淀E可能含有BaSO3 | ||
| C. | 气体A、C一定均为纯净物 | D. | 固体X可能出现含有K2SO3、K2CO3 |

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)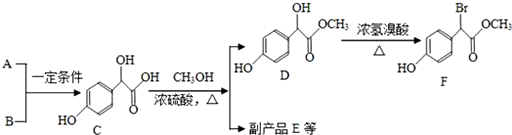
 .
.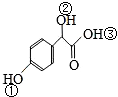 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.