题目内容
20.SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2和Cl2按1:1体积比(同温同压)混合后通人品红溶液中,品红溶液不褪色,其原因是Cl2和SO2在水溶液中按1:1反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,由于氯气和二氧化硫恰好反应,所以品红不会褪色.分析 在同温同压下将SO2和Cl2按1:1体积比混合后,通入品红溶液中发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,
解答 解:氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现;二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质,加热会恢复原来的颜色,Cl2和SO2等物质的量混合通入品红溶液,Cl2和SO2在水溶液中按1:1反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,由于氯气和二氧化硫恰好反应,所以品红不会褪色,
故答案为:Cl2和SO2在水溶液中按1:1反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,由于氯气和二氧化硫恰好反应,所以品红不会褪色.
点评 本题考查了Cl2和SO2的漂白性,注意氯气和二氧化硫1:1混合会恰好发生氧化还原反应生成硫酸和盐酸,反应后无漂白作用,题目难度不大.

练习册系列答案
相关题目
10.在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C (s)+H2O(g)?CO(g)+H2(g)下列叙述中可以认定上述可逆反应已达到化学平衡状态的是( )
| A. | 容器内压强不再发生变化 | |
| B. | v正(CO)=v正(H2O) | |
| C. | 生成n mol CO的同时,消耗n mol H2O | |
| D. | 1 mol H-H键断裂的同时,形成2 mol H-O键 |
11.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
8.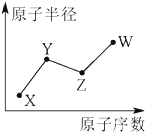 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
5.在元素周期表中,金属与非金属的交界线两边的元素,通常能作为( )
| A. | 合金 | B. | 农药 | C. | 半导体 | D. | 催化剂 |
2.有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:(1)1molX与足量的金属钠反应产生1.5mol气体 (2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物 (3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是( )
根据上述信息,对X的结构判断正确的是( )
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
3.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示).

下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 | |
| B. | 过程②中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| C. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| D. | 在过程③⑤中溴元素均被氧化 |