题目内容
3.油脂A的通式如图,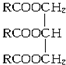 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
分析 从油脂A与溴发生加成反应时物质的量之比,可求出油脂分子中双键的个数.然后从与A具有相同碳原子数的高级饱和脂肪酸甘油酯应具有的化学通式,推知油脂A的化学通式.最后从燃烧后生成的CO2和H2O的总物质的量可求出油脂A的化学式和结构简式.油脂A与氢气发生加成反应,变为饱和脂肪酸甘油酯.
解答 解:设与油脂A中羧酸具有相同碳原子数的饱和高级脂肪酸为CnH2nO2,则形成的甘油酯的化学式为C3n+3H6n+2O6,0.1molA消耗Br2的物质的量为$\frac{96g}{160g/mol}$=0.6mol,即1mol的油脂A与Br2完全加成时消耗的Br2为6mol,故油脂A是不饱和高级脂肪酸的甘油酯,每个不饱和高级脂肪酸中应含有两个C=C键,即A的通式为C3n+3H6n-10O6.
每摩尔A完全燃烧可生成CO2(3n+3)mol,生成H2O(3n-5)mol,故有0.1×(3n+3)+0.1×(3n-5)=10.6,n=18,所以A的结构简式为 ,
,
油脂A与氢气发生加成反应,变为饱和脂肪酸甘油酯,化学方程式为 ,
,
答:油脂的结构简式为 ,油脂氢化的方程式为
,油脂氢化的方程式为 .
.
点评 本题考查有机物的分子式计算的确定,为高频考点,把握加成规律及燃烧规律为解答的关键,侧重分析与应用能力的考查,注意原子守恒法的应用,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | SO2和Cl2使品红溶液褪色的原理相同 | |
| B. | 浓硫酸分别使胆矾变白、蔗糖变黑时,浓硫酸表现的性质相同 | |
| C. | 浓硝酸和浓硫酸露置在空气中,浓度都降低的原因相同 | |
| D. | 浓硫酸与稀硫酸都能与金属锌反应放出气体,两个反应的氧化产物相同 |
11.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
18.己知:KI溶液在酸性条件下能被空气中的O2氧化,反应的离子方程式为:O2+4I-+4H+═2I2+2H2O.
(I)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、1mol/L KOH溶液、淀粉溶液)
(2)在上述实验中,三种溶液混合的顺序最合理的是C(选填下列选项);应记录的内容溶液从无色变为蓝色所需的时间.
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
(限选试剂:1mol/L盐酸、1mol/L KOH溶液、碘水、淀粉溶液)
(I)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、1mol/L KOH溶液、淀粉溶液)
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
8.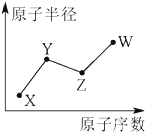 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
5.在元素周期表中,金属与非金属的交界线两边的元素,通常能作为( )
| A. | 合金 | B. | 农药 | C. | 半导体 | D. | 催化剂 |
6.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
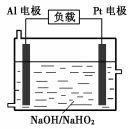 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下: