题目内容
17.在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是( )| A. | 硝酸表现出了氧化性和酸性 | B. | 还原剂与氧化剂之比为1:4 | ||
| C. | 每个硝酸分子得到2个电子 | D. | 硝酸铜是还原产物 |
分析 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中Cu元素的化合价升高,N元素的化合价降低,硝酸反应生成硝酸盐时表现出酸性,据此分析解答.
解答 解:A.反应生成二氧化氮和硝酸铜,则硝酸表现氧化性和酸性,故A正确;
B.N元素化合价降低,硝酸为氧化剂,Cu元素化合价升高,则Cu为还原剂,所以还原剂与氧化剂之比为1:2,故B错误;
C.反应中N元素化合价由+5降低到+4,则每个硝酸分子得1个电子,故C错误;
D.Cu元素化合价升高,生成硝酸铜是氧化产物,故D错误.
故选A.
点评 本题考查氧化还原反应,明确硝酸中氮元素的化合价变化是解答本题的关键和难点,题目难度不大.

练习册系列答案
相关题目
20.下列说法中正确的是( )
| A. | 油脂在碱性条件下水解可生成甘油和高级脂肪酸 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 医用酒精的体积分数通常是90% | |
| D. | 对“地沟油”进行分馏可得到汽油 |
5.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中再分别滴加CCl4震荡静置 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 将充满NO2的密闭玻热水中璃球浸泡在 | 红棕色变深 | 反应2NO2?N2O4的△H<0 |
| A. | A | B. | B | C. | C | D. | D |
12.决定气体体积大小的主要因素是( )
①气体分子的数目
②气体分子的直径
③气体分子间的距离
④气体分子的质量.
①气体分子的数目
②气体分子的直径
③气体分子间的距离
④气体分子的质量.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
2.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 78g Na2O2与足量水反应中电子转移了2NA | |
| B. | 只有在标准状况下NA个氧气分子的物质的量才是1mol | |
| C. | 16g CH4中含有4 NA个C-H键 | |
| D. | 在铜与硫的反应中(生成硫化亚铜),1 mol铜失去的电子数为2NA |
9.配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是( )
| A. | 移液时,不慎将液体流到瓶外 | |
| B. | 容量瓶中原有少量的蒸馏水 | |
| C. | 容量瓶盛过Na2CO3溶液,使用前未洗涤 | |
| D. | 定容时读数仰视 |
6.以下说法中正确的是( )
| A. | 测定溶液的酸碱度时,先将pH试纸用水润湿,后沾上被测溶液 | |
| B. | 点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃 | |
| C. | 实验室稀释浓硫酸时,可以在量筒中进行 | |
| D. | 试管和烧杯都可以直接用火焰加热 |
7.儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用.下列说法正确的是( )
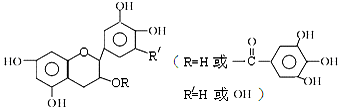

| A. | 儿茶素能与FeCl3溶液发生显色反应 | |
| B. | 1mol儿茶素最多可与10mol NaOH反应 | |
| C. | 常温下,儿茶素不溶于水,也不溶于有机溶剂 | |
| D. | 儿茶素一定不能发生水解反应 |