题目内容
5.下列有关实验现象和解释或结论都正确的是( )| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中再分别滴加CCl4震荡静置 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 将充满NO2的密闭玻热水中璃球浸泡在 | 红棕色变深 | 反应2NO2?N2O4的△H<0 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有漂白性,但二氧化硫不能漂白指示剂;
B.少量的溴水分别滴入FeCl2溶液、NaI溶液中,分别反应生成铁离子、碘单质,不能比较亚铁离子、碘离子的还原性;
C.该钾盐可能为碳酸氢钾,不一定为碳酸钾;
D.红棕色变深,说明二氧化氮的浓度增大,平衡向着逆向移动.
解答 解:A.二氧化硫溶于水呈酸性,所以把SO2通入紫色石蕊试液中紫色石蕊变红,二氧化硫不能漂白指示剂,故A错误;
B.将少量的溴水分别滴入FeCl2溶液、NaI溶液中再分别滴加CCl4震荡静置,下层分别呈无色和紫红色,证明溴单质的氧化成大于铁离子、碘单质,只能说明还原性:I->Br-、Fe2+>Br-,无法判断I-、Fe2+的还原性强弱,故B错误;
C.某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水,生成的白色沉淀为碳酸钙,原溶液中可能含有碳酸氢钾,不一定为K2CO3,故C错误;
D.将充满NO2的密闭玻璃球浸泡在热水中,红棕色变深,说明升高温度平衡2NO2?N2O4向着逆向移动,则该反应为放热反应,其焓变△H<0,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及二氧化硫向着、物质检验、氧化还原反应、反应热与焓变等知识,明确化学平衡及其影响、氧化性还原性强弱比较方法为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.关于阿斯匹林的作用叙述中不正确的是( )
| A. | 杀菌消炎 | B. | 解热镇痛 | C. | 防止心脏病发作 | D. | 提高免疫力 |
13.下列化学用语表示正确的是( )
| A. | 氯气的电子式:Cl:Cl | |
| B. | 乙烯的结构简式CH2CH2 | |
| C. | 钠原子的结构示意图: | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
20.下列两种失去标签的无色透明溶液,不可以通过互滴的方法将其鉴别的是( )
| A. | 碳酸钠溶液与稀盐酸 | B. | 明矾溶液与氢氧化钠溶液 | ||
| C. | 碳酸氢钠溶液与稀盐酸 | D. | 偏铝酸钠溶液与稀盐酸 |
10.某溶液可能存在Na+、Ba2+、Mg2+、Fe3+、Br-、CO32-、Cl-等离子,某学生进行下列实验:取少量原溶液,测得溶液呈强碱性,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色.关于该原溶液的推测正确的是( )
| A. | 溶液中可能存在Mg2+和Fe3+ | B. | 溶液中可能存在Br-和Cl- | ||
| C. | 溶液可能存在Ba2+和Cl- | D. | 溶液中一定存在Na+和CO32- |
17.在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是( )
| A. | 硝酸表现出了氧化性和酸性 | B. | 还原剂与氧化剂之比为1:4 | ||
| C. | 每个硝酸分子得到2个电子 | D. | 硝酸铜是还原产物 |
14.在如图实验中,下列说法错误的是( )
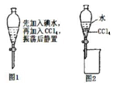

| A. | 从碘水中提取单质碘时,不能用无水乙醇代替四氯化碳 | |
| B. | 进行如图1操作后,实验现象为液体分层,下层呈无色 | |
| C. | 利用如图2装置可以分离四氯化碳和水 | |
| D. | 在这个操作中,应选择有机萃取剂,且萃取剂不溶于水 |



