题目内容
2.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 78g Na2O2与足量水反应中电子转移了2NA | |
| B. | 只有在标准状况下NA个氧气分子的物质的量才是1mol | |
| C. | 16g CH4中含有4 NA个C-H键 | |
| D. | 在铜与硫的反应中(生成硫化亚铜),1 mol铜失去的电子数为2NA |
分析 A.过氧化钠与水反应为歧化反应;
B.1mol任何物质都含有NA个微粒;
C.质量转化为物质的量,结合1个甲烷分子含有4个C-H键解答;
D.依据铜化合价由0价升高为+1价解答.
解答 解:A.78g Na2O2物质的量为1mol,与足量水反应中电子转移了NA,故A错误;
B.任何状况下NA个氧气分子的物质的量才是1mol,故B错误;
C.16g CH4中含有C-H键个数为:$\frac{16g}{16g/mol}$×4×NA=4 NA个,故C正确;
D.在铜与硫的反应中(生成硫化亚铜),1 mol铜失去的电子生成1molCu+,转移电子数为NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数计算及应用,明确以物质的量为核心计算公式是解题关键,注意气体摩尔体积使用条件和对象,注意过氧化钠与水反应中过氧化钠既是氧化剂又是还原剂特点,题目难度中等.

练习册系列答案
相关题目
5.用 NA 表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | T℃1 L pH=6 的纯水中含 10-6 NA个 OH | |
| B. | 6.0 g SiO2 晶体中含有 0.1 NA 个 SiO2分子 | |
| C. | 标准状况下,22.4 L HF 所含电子数为 10NA | |
| D. | 标准状况下,22.4 L 氧气作氧化剂时转移电子数一定为 4NA |
13.下列化学用语表示正确的是( )
| A. | 氯气的电子式:Cl:Cl | |
| B. | 乙烯的结构简式CH2CH2 | |
| C. | 钠原子的结构示意图: | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
10.某溶液可能存在Na+、Ba2+、Mg2+、Fe3+、Br-、CO32-、Cl-等离子,某学生进行下列实验:取少量原溶液,测得溶液呈强碱性,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色.关于该原溶液的推测正确的是( )
| A. | 溶液中可能存在Mg2+和Fe3+ | B. | 溶液中可能存在Br-和Cl- | ||
| C. | 溶液可能存在Ba2+和Cl- | D. | 溶液中一定存在Na+和CO32- |
17.在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是( )
| A. | 硝酸表现出了氧化性和酸性 | B. | 还原剂与氧化剂之比为1:4 | ||
| C. | 每个硝酸分子得到2个电子 | D. | 硝酸铜是还原产物 |
14.在如图实验中,下列说法错误的是( )
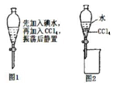

| A. | 从碘水中提取单质碘时,不能用无水乙醇代替四氯化碳 | |
| B. | 进行如图1操作后,实验现象为液体分层,下层呈无色 | |
| C. | 利用如图2装置可以分离四氯化碳和水 | |
| D. | 在这个操作中,应选择有机萃取剂,且萃取剂不溶于水 |
11.关于氧化剂的叙述正确的是( )
| A. | 得电子越多,其氧化性越强 | B. | 分子中一定含有氧元素 | ||
| C. | 在反应中易失电子的物质 | D. | 在反应中易结合电子的物质 |
12.在一定条件下发生如下反应:COCl2(g)$\stackrel{催化剂}{?}$CO(g)+Cl2(g)△H<0下列有关说法正确的是( )
| A. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| B. | 用催化剂能提高反应物的平衡转化率 | |
| C. | 平衡时其他条件不变,升高温度能提高COCl2的转化率 | |
| D. | 当反应达平衡时,恒温恒压条件下通入Ar能提高COCl2的转化率 |