题目内容
9.配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是( )| A. | 移液时,不慎将液体流到瓶外 | |
| B. | 容量瓶中原有少量的蒸馏水 | |
| C. | 容量瓶盛过Na2CO3溶液,使用前未洗涤 | |
| D. | 定容时读数仰视 |
分析 结合c=$\frac{n}{V}$及不当操作可知,n偏大或V偏小,导致浓度偏高,以此来解答.
解答 解:A.移液时,不慎将液体流到瓶外,n偏小,则c偏低,故A不选;
B.容量瓶中原有少量的蒸馏水,对实验无影响,c不变,故B不选;
C.容量瓶盛过Na2CO3溶液,使用前未洗涤,n偏大,导致浓度偏高,故C选;
D.定容时读数仰视,V偏大,c偏低,故D不选;
故选C.
点评 本题考查配制一定浓度的溶液,为高频考点,把握配制溶液的操作及误差分析为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
相关题目
12.关于有机物 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 能与溴水发生加成反应 | B. | 分子中所有的碳原子在同一平面上 | ||
| C. | 能与碳酸氢钠发生反应 | D. | 能发生取代、氧化反应 |
20.下列两种失去标签的无色透明溶液,不可以通过互滴的方法将其鉴别的是( )
| A. | 碳酸钠溶液与稀盐酸 | B. | 明矾溶液与氢氧化钠溶液 | ||
| C. | 碳酸氢钠溶液与稀盐酸 | D. | 偏铝酸钠溶液与稀盐酸 |
17.在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是( )
| A. | 硝酸表现出了氧化性和酸性 | B. | 还原剂与氧化剂之比为1:4 | ||
| C. | 每个硝酸分子得到2个电子 | D. | 硝酸铜是还原产物 |
4.气体体积的大小,跟下列因素几乎无关的是( )
| A. | 分子个数 | B. | 分子直径 | C. | 压强 | D. | 温度 |
14.在如图实验中,下列说法错误的是( )
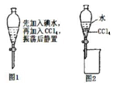

| A. | 从碘水中提取单质碘时,不能用无水乙醇代替四氯化碳 | |
| B. | 进行如图1操作后,实验现象为液体分层,下层呈无色 | |
| C. | 利用如图2装置可以分离四氯化碳和水 | |
| D. | 在这个操作中,应选择有机萃取剂,且萃取剂不溶于水 |
1.某烃中碳和氢的质量比为24:5,该烃在标准状况下的密度是2.59g•L-1,该烃的分子式为( )
| A. | C2H6 | B. | C4H10 | C. | C5H8 | D. | C4H8 |
18.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大 小.按照“酸碱质子理论”,下列说法正确的是( )
| A. | 2Na+2H2O=2NaOH+H2↑是酸碱反应 | |
| B. | ClO-+H2O?HClO+OH-是酸碱反应 | |
| C. | 碱性强弱顺序:OH->ClO->CH3COO- | |
| D. | HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
19.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸发结晶时应将溶液完全蒸干 | |
| D. | 洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次 |