题目内容
已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
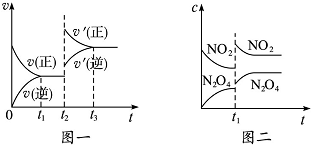

| A、图一t2时改变的条件可能是升高了温度或增大了压强 |
| B、图一t2时改变的条件一定是增大了反应物的浓度 |
| C、图二t1时改变的条件可能是升高了温度或增大了压强 |
| D、若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:CO(g)+H2(g)?C(s)+H2O(g)是反应气体体积减小的吸热反应,图一t2时改变条件时,正逆反应速率都增大,且正反应速率大于逆反应速率,说明平衡向正反应方向移动,改变条件是温度或压强;
2NO2(g)?N2O4(g)是反应前后气体体积减小的放热反应,图二t1时改变条件两种物质反应速率都增大,且反应物反应速率大于生成物,平衡向正反应方向移动,据此分析解答.
2NO2(g)?N2O4(g)是反应前后气体体积减小的放热反应,图二t1时改变条件两种物质反应速率都增大,且反应物反应速率大于生成物,平衡向正反应方向移动,据此分析解答.
解答:
解:CO(g)+H2(g)?C(s)+H2O(g)是反应气体体积减小的吸热反应,图一t2时改变条件时,正逆反应速率都增大,且正反应速率大于逆反应速率,说明平衡向正反应方向移动,增大压强平衡正向移动,所以改变条件可能是升高温度或增大压强;
2NO2(g)?N2O4(g)是反应前后气体体积减小的放热反应,图二t1时改变条件两种物质反应速率都增大,且反应物反应速率大于生成物,平衡向正反应方向移动,
如果是升高温度,平衡向逆反应方向移动,则只能是减小容器体积即增大压强,平衡向正反应方向移动,气体的物质的量减小,则混合气体的平均分子质量将增大,
故选A.
2NO2(g)?N2O4(g)是反应前后气体体积减小的放热反应,图二t1时改变条件两种物质反应速率都增大,且反应物反应速率大于生成物,平衡向正反应方向移动,
如果是升高温度,平衡向逆反应方向移动,则只能是减小容器体积即增大压强,平衡向正反应方向移动,气体的物质的量减小,则混合气体的平均分子质量将增大,
故选A.
点评:本题考查图象分析,侧重考查学生分析问题、灵活运用知识解答问题能力,会根据反应速率相对大小确定平衡移动方向,知道温度、压强、浓度、催化剂对反应速率的影响并会画其速率-时间图象,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
运用元素周期律分析下面的推断正确的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
在一定温度下的定容密闭容器中,当下列物理量不再随时间变化时,表明反应:A (s)+2B (g)≒C (g)+D (g) 一定已达到平衡状态的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的物质的量 |
| D、混合气体中C和D的物质的量比 |
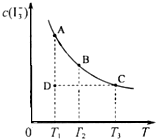 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C、若反应进行到状态D时,平衡向逆反应方向移动 |
| D、状态B与状态C相比,状态C的c(I2)大 |
 可连接在E处,则Cl2从
可连接在E处,则Cl2从