题目内容
3.Fe、Fe2+、Fe3+三种微粒具有相同的:①质子数 ②中子数 ③核外电子数 ④化学性质( )| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
分析 Fe2+、Fe3+分别是Fe失去2个电子和3个电子形成的阳离子,而原子能得失的只有电子,故Fe原子在变为Fe2+、Fe3+时发生的只是电子的得失,质子数、中子数均不变,据此分析.
解答 解:Fe2+、Fe3+分别是Fe失去2个电子和3个电子形成的阳离子,而原子能得失的只有电子,故Fe原子在变为Fe2+、Fe3+时发生的只是电子的得失,质子数、中子数均不变.
①三者中的质子数相同,均为26个,故正确;
②原子能得失的只有电子,中子数不变,故三者中的中子数相同,故正确;
③Fe原子在变为Fe2+、Fe3+时分别失去了2个和3个电子,故三者的核外电子数不同,故错误;
④三者的核外电子排布不同,故化学性质不同,故错误.
故选A.
点评 本题考查了原子在变为离子时的结构变化,应注意的是原子能得失的只有电子,质子数和中子数均不变.

练习册系列答案
相关题目
13.保护环境已成为人类的共识,下列做法不利于环境保护的是( )
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
11.根据如图的溶解度曲线判断,下列说法错误的是( )
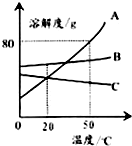

| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
18.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
8.下列混合物的分离或提纯操作不正确的是( )
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
13.保存下列物质的方法正确是( )
| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
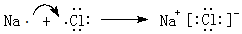 .
.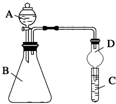 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.