题目内容
13.保存下列物质的方法正确是( )| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
分析 A.氢氟酸能够与玻璃中的二氧化硅反应;
B.稀硫酸能够与铁反应;
C.氯水中的次氯酸见光分解;
D.水玻璃为硅酸钠水溶液,具有粘性.
解答 解:A.氢氟酸能够与玻璃中的二氧化硅反应,能腐蚀玻璃,所以不能用玻璃瓶盛放氢氟酸,故A错误;
B.稀硫酸能够与铁反应,腐蚀铁,所以不能用铁通盛放稀硫酸,故B错误;
C.氯水中的次氯酸不稳定,见光分解,所以新制氯水应用棕色瓶盛放,故C正确;
D.水玻璃为硅酸钠水溶液,具有粘性,能够将玻璃塞与玻璃瓶粘到一起,所以不能用带磨口的玻璃塞盛放水玻璃,故D错误;
故选:C.
点评 本题考查了试剂的保存,明确相关物质的性质是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
相关题目
3.Fe、Fe2+、Fe3+三种微粒具有相同的:①质子数 ②中子数 ③核外电子数 ④化学性质( )
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
4.常温下,pH=2的二元弱酸H2R溶液与pH=12的NaOH溶液混合后,混合液的pH=7,下列判断正确的是.
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
1.以下是元素周期表的一部分,回答下列有关问题:
(1)与水反应最剧烈的金属元素是K;元素构成的最稳定气态氢化物的化学式是HF;③、④、⑧元素原子半径由大到小是Si>N>O(用元素符号作答).
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为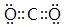 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程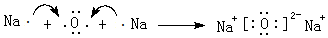 .
.
(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为
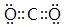 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程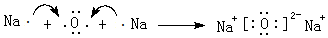 .
.(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
8.如图是某水溶液在 pH 从 0 至 14 的范围内 H2CO3、HCO3-、CO2-组成分数.下列叙述正确的是( )
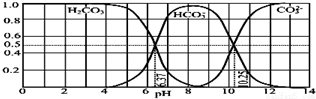

| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
18.下列说法中正确的是( )
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
2.下列对4g氦气的说法正确的是( )
| A. | 标准状况下的体积为11.2L | B. | 含NA个氦气分子 | ||
| C. | 含NA个电子 | D. | 物质的量为0.5mol |
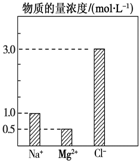 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: