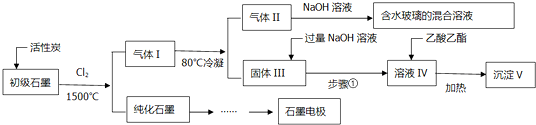
题目内容
1.常温下列各组离子在指定溶液中可能大量共存的是( )| A. | 能使淀粉碘化钾试纸显蓝色的溶液:Na+、H+、I-、SO32- | |
| B. | 饱和CO2的溶液中:Ca2+、K+、NO3-、Cl- | |
| C. | 在pH=14的溶液中:Na+、K+、Cl-、SO2 | |
| D. | 无色透明溶液:Na+、Ba2+、MnO4-、Cl- |
分析 A.能使淀粉碘化钾试纸显蓝色的溶液,具有氧化性;
B.饱和CO2的溶液,显酸性;
C.pH=14的溶液,显碱性;
D.MnO4-为紫色.
解答 解:A.能使淀粉碘化钾试纸显蓝色的溶液,具有氧化性,分别与I-、SO32-发生氧化还原反应不能共存,故A不选;
B.饱和CO2的溶液,显酸性,该组离子之间不反应,可大量共存,故B选;
C.pH=14的溶液,显碱性,不能大量存在SO2,故C不选;
D.MnO4-为紫色,与无色不符,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答本题的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
9.0.2L某混合溶液中溶质除了0.1mol HNO3之外,还含有NaCl、MgCl2、AlCl3,测得该溶液中部分离子浓度大小如表所示:
请回答下列问题:
(1)该混合液中,溶质NaCl的物质的量为0.1mol,溶质MgCl2的质量为19g.
(2)若要使该混合液中Cl-沉淀完全,则需加入0.1mol•L-1 AgNO3溶液的体积为8L.
(3)若将该混合液加水稀释至体积为1L,则稀释后溶液中Na+的物质的量浓度为0.1mol/L.
请回答下列问题:
| 离子 | Na+ | Mg2+ | Al3+ |
| 浓度/mol•L-1 | 0.5 | 1.0 | 0.5 |
(2)若要使该混合液中Cl-沉淀完全,则需加入0.1mol•L-1 AgNO3溶液的体积为8L.
(3)若将该混合液加水稀释至体积为1L,则稀释后溶液中Na+的物质的量浓度为0.1mol/L.
16.已知A、B、C、D是短周期中原子序数依次增大的四种主族元素.A2在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显碱性 |
6.某晶体溶于水配成溶液,向该溶液中滴加Ba(OH)2溶液,加热,产生能使湿润红色石蕊试纸变蓝色的气体和白色沉淀,随着Ba(OH)2溶液增多,白色沉淀由少到最大量,随后沉淀量逐渐减小至恒量.由此推知,该晶体所含离子可能有( )
| A. | NH4+、Fe3+、SO42-、Cl- | B. | NH4+、Mg2+、SO42- | ||
| C. | NH4+、Cl-、SO42- | D. | NH4+、Al3+、SO42- |
13.下列说法不正确的是( )
| A. | 在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 常温下,NH4Cl溶液加水稀释$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$不变 | |
| C. | 向硅酸钠溶液中滴加酚酞,溶液变红,证明了Na2SiO3发生了水解 | |
| D. | 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化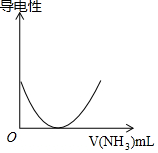 |
14.黄酒在存放过程中,有部分乙醇转化为乙酸,导致黄酒变酸.该过程中发生的反应为( )
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 酯化反应 |