题目内容
10.测血钙的含量时,进行如下实验:①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氣化产物为CO2,还原产物为Mn2+.
③终点时用去20mL l.0×l0-4 mol./L的KMnO4溶液.
(1)写出用KMn04滴定H2C2O4的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.
(2)判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色.
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数偏大(填“偏大”、“偏小”或“无影响”).
(4)计算:血液中含钙离子的浓度为2.5×10-3mol/L.
分析 (1)用酸性KMnO4溶液滴定H2C2O4溶液,发生氧化还原反应生成二氧化碳,锰离子和水,结合电荷守恒、电子守恒和原子守恒书写;
(2)利用高锰酸钾溶液的紫红色指示反应的终点,颜色变化后半分钟不变证明反应达到终点;
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,消耗标准溶液体积增大;
(4)5CaC2O4~5H2C2O4~2KMnO4的定量关系计算;
解答 解:(1)用酸性KMnO4溶液滴定H2C2O4溶液,高锰酸钾具有强氧化性能氧化草酸发生氧化还原反应生成二氧化碳,锰离子和水,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(2)判断滴定终点的方法是:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,消耗高锰酸钾溶液体积增大,计算测得的血钙质量分数偏大,
故答案为:偏大;
(4)定量关系可知,5CaC2O4~5H2C2O4~2KMnO4,
5 2
n 0.020L×l.0×l0-4 mol/L
n=5.0×10-6mol,
血液中含钙离子的浓度=$\frac{2.5×1{0}^{-3}mol}{0.002L}$=2.5×10-3,
故答案为:2.5×10-3;
点评 本题考查了氧化还原反应滴定实验过程、定量计算和物质性质的分析应用,掌握基础是解题关键,题目难度不大.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 2-甲基-2-乙基戊烷 | B. | 3-甲基--己烯 | ||
| C. | 2-甲基-4-庚炔 | D. | 1,2,4-三甲苯 |
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:Na+、H+、I-、SO32- | |
| B. | 饱和CO2的溶液中:Ca2+、K+、NO3-、Cl- | |
| C. | 在pH=14的溶液中:Na+、K+、Cl-、SO2 | |
| D. | 无色透明溶液:Na+、Ba2+、MnO4-、Cl- |
| A. | CH3CH═CHCH2CH3 | B. | CH2═CHCH═CH2 | C. | CH2═CHCH3 | D. | CH3-CH═CH-CH3 |
| 材料 | 主要化学成分 | |
| A | 水垢 | 碳酸钙 |
| B | 刚玉、钻石 | 三氧化二铅 |
| C | 古代陶瓷、普通玻璃 | 硅酸盐 |
| D | 水晶、硅藻土 | 二氧化硅 |
| A. | A | B. | B | C. | C | D. | D |
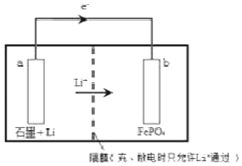 某种锂离子二次电池的总反应为:FePO4(s)+Li(s)?LiFePO4(s),装置如图所示(a极材料为金属锂和石墨的复合材料).下列说法不正确的是( )
某种锂离子二次电池的总反应为:FePO4(s)+Li(s)?LiFePO4(s),装置如图所示(a极材料为金属锂和石墨的复合材料).下列说法不正确的是( )| A. | 图中e-及Li+移动方向说明该电池处于放电状态 | |
| B. | 该电池中a极不能接触水溶液 | |
| C. | 充电时a极连接外接电源的正极 | |
| D. | 充电时,b极电极反应式为:LiFePO4-e-═Li++FePO4 |

| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
| A. | 甲基橙 | B. | 圆底烧瓶 | C. | 锥形瓶 | D. | 滴定管 |
| A. | 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1mol苯中所含碳碳双键的数目为3NA |