题目内容
17.燃烧92g的乙醇需要标准状况下的氧气体积为33.6L.分析 标准状况下1mol氧气的体积为22.4L,写出乙醇燃烧的化学方程式,然后利用等量代换列出各数据及消耗氧气的方程式,从而可计算出消耗氧气的体积.
解答 解:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O
46g 67.2L
92g V(O2)
则:$\frac{46g}{92g}$=$\frac{67.2L}{V({O}_{2})}$,
解得:V(O2)=33.6L,
故答案为:33.6L.
点评 本题考查了化学方程式的计算、物质的量的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
7.下列有关溶液组成的描述合理的是( )
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
8.用32gCu与300mL12mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是( )
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
5.四种短周期元素a、b、c、d在周期表中的位置关系如表所示,下列有关a、b、c、d四种元素的叙述中正确的是( )
| ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| a | b | |||
| c | d |
| A. | a的氢化物水溶液显酸性 | |
| B. | 在这4种元素中,b的氢化物热稳定性最好 | |
| C. | c的氧化物是碱性氧化物 | |
| D. | d的氧化物对应水化物一定是强酸 |
12.下列条件变化会使H2O的电离平衡向电离方向移动,且pH<7的是( )
| A. | 常温下,向水中加少量稀盐酸 | B. | 将纯水加热到100℃ | ||
| C. | 常温下,向水中加少量Na | D. | 常温下,向水中加少量Na2CO3固体 |
2.化学与生活、生产、环境密切相关,下列有关说法正确的是( )
| A. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 地沟油的主要成分和汽油、柴油相同,可以添加到汽油中做燃料 | |
| C. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| D. | “水滴石穿”、“绳锯木断”的过程中都包含化学变化 |
17.常温下,一定量的乙酸溶液与氢氧化钠溶液发生中和反应,下列说法正确的( )
| A. | c(CH3COO-)=c(Na+)时,参加反应的乙酸与氢氧化钠的物质的量之比为1:1 | |
| B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量 | |
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 | |
| D. | c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
18.分子式C4H8O为并能与金属Na反应放出气体的单官能团的有机物(不含立体异构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 ,
, +2Na→
+2Na→ +H2↑
+H2↑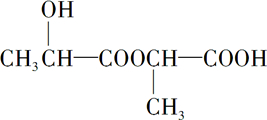 .
.