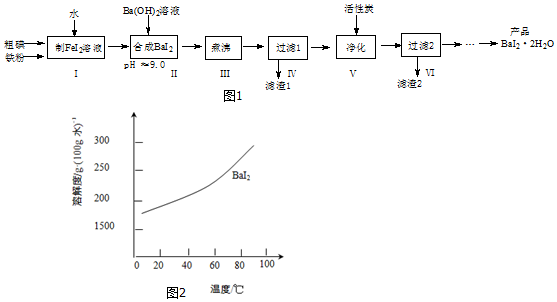
题目内容
6.已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以与强碱反应生成盐和水,则A应该属于d(用字母代号填写).
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被还原的元素是硫(填元素名称);氧化产物是CuSO4(填化学式).
(3)若反应消耗了3.2g Cu,则转移电子数6.02×1022,被还原的硫酸物质的量为0.05mol.
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,写出此过程发生反应的离子方程式:Ba2++SO42-=BaSO4↓.
分析 (1)由反应可知,A为二氧化硫,为酸性氧化物,根据硫酸的作用来回答;
(2)化合价降低的元素被还原;化合价升高后得到的产物为氧化产物;
(3)若反应消耗了3.2g Cu,物质的量为:0.05mol,则转移电子数0.05mol×2×6.02×1023,被还原的硫酸物质的量为0.05mol;
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,钡离子与硫酸根离子反应生成硫酸钡.
解答 解:(1)反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+A↑+2H2O中,A物质可以导致酸雨的形成,则A是二氧化硫,应该属于酸性氧化物,在参加反应的硫酸中,被还原的硫酸是1mol与未被还原的硫酸是1mol,其物质的量之比为1:1,
故答案为:d;
(2)化合价降低的元素被还原,所以被还原的元素是硫;化合价升高后得到的产物为氧化产物,即氧化产物为:CuSO4,故答案为:硫;CuSO4;
(3)若反应消耗了3.2g Cu,物质的量为:0.05mol,则转移电子数0.05mol×2×6.02×1023,被还原的硫酸物质的量为0.05mol;故答案为:6.02×1022;0.05;
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,钡离子与硫酸根离子反应生成硫酸钡,离子方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查较为综合,涉及氧化还原反应、浓硫酸、二氧化硫的性质以及离子方程式的书写,侧重于学生的分析能力和计算能力的考查,为高考常见题型,难度中等,注意把握反应的相关方程式,结合方程式计算.

练习册系列答案
相关题目
16.已知25℃时,几种难溶电解质的溶度积常数Ksp如表所示:
下列叙述不正确的是( )
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
17.某温度下,在一个容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应达到平衡时,测得容器中各物质均为nmol,现欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施不可行的是( )
| A. | 将容器体积变为原来一半 | B. | 压强变为原来一半 | ||
| C. | 加入2n molCO,2n molH2O | D. | 加入2n molCO2和2n molH2 |
11.水热法制直径为1到100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
15.在1LK2SO4和CuSO4的混合溶液中,C(SO42-)=2mol•L-1,用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |