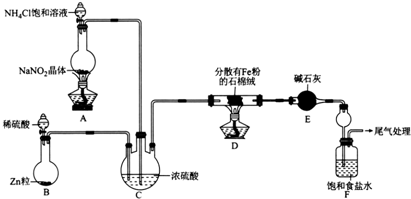
题目内容
5.(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,该反应中每生成1mol HCl时释放145kJ的热量,写出这个反应的热化学方程式:C(s)+2Cl2(g)+2H2O(g)=CO2(g)+4HCl(g)△H=-580kJ/mol(2)已知N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其中N≡N键的键能为946kJ•mol-1,氧分子中氧氧键的键能为498kJ•mol-1,则一氧化氮分子中氮氧键的键能为632kJ•mol-1.
(3)已知下列热化学方程式:
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s);?△H=-348.3kJ•mol-1
4Ag(s)+O2(g)═2Ag2O(s);?△H=-62.0kJ•mol-1
由此可知反应:Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H为-317.3 kJ/mol.
分析 (1)反应热与反应计量数呈正比,依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变;
(2)根据反应热与键能的计算关系计算反应热,断键吸热,成键放热,N2+O2═2NO,形成2mol氮氧键需断裂1mol氮氮键、1mol氧氧键.
(3)根据已知方程式构建目标方程式,根据盖斯定律可知反应热与反应计量数呈正比.
解答 解:(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,反应为:2Cl2+2H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,当生成1mol HCl时释放145kJ的热量,生成4molHCl放热145×2=580 kJ,热化学方程式为:C(s)+2Cl2(g)+2H2O(g)=CO2(g)+4HCl(g)△H=-580kJ/mol;
故答案为:C(s)+2Cl2(g)+2H2O(g)=CO2(g)+4HCl(g)△H=-580kJ/mol;
(2)化学反应中断裂化学键要吸热,形成新化学键要放热,则有
断裂1molN2(g)中的N≡N和1molO2(g)中的O=O共吸收的能量为:946kJ+498kJ=1444kJ,
设1molNO分子中的化学键形成时可释放xkJ的能量,
则有:1444kJ-2xkJ=180kJ,x=632,则一氧化氮分子中氮氧键的键能为632KJ/mol,
故答案为:632;
(3)①Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s);?△H=-348.3kJ•mol-1
②4Ag(s)+O2(g)═2Ag2O(s);?△H=-62.0kJ•mol-1
①-②×$\frac{1}{2}$得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)△H=[-348.3KJ/mol-$\frac{1}{2}$×(-62KJ/mol)]=-317.3 kJ/mol,
故答案为:-317.3 kJ/mol.
点评 本题综合考查热化学方程式的书写和计算等问题,题目难度中等,注意从化学键的角度计算反应热的方法,注意盖斯定律的应用.

 阅读快车系列答案
阅读快车系列答案| T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.80 | 1.00 | 0 |
| 1 | 0.70 | 0.80 | |
| 5 | 0.70 | ||
| 9 | 0.40 | ||
| 10 | 0.40 | 0.80 |
(2)反应进行到10min,X的转化率为50%,0~5min内Y的平均反应速率为0.07mol/(L•min)
(3)计算T℃时该反应的平衡常数K=80L/mol
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正大于v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如图A、B所示:

①10min时改变的反应条件是增大Y的浓度
②t3时刻改变的反应条件是降低温度?t5时刻改变的反应条件是加催化剂,理由是t5时刻正逆反应速率同等程度增大且相等.
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
| A. | 用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| B. | 将BaSO4固体加入到饱和Na2CO3溶液中,充分反应后过滤、洗涤;往滤渣中滴加稀盐酸,有气体产生,则证明此条件下Ksp(BaSO4)>Ksp(BaCO3) | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸可提高反应速率和乙酸乙酯的转化率 |
| A. | 将容器体积变为原来一半 | B. | 压强变为原来一半 | ||
| C. | 加入2n molCO,2n molH2O | D. | 加入2n molCO2和2n molH2 |
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |