题目内容
4.下列叙述正确的是( )| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
分析 A.如为吸热反应,则生成物能量大于反应物总能量;
B.如△H-T•△S<0,则反应可自发进行;
C.如正逆反应速率相等,则平衡不移动;
D.反应热取决于反应物与生成物的总能量.
解答 解:A.化学反应的焓变与反应物、生成物的总能量大小有关,如为吸热反应,则生成物能量大于反应物总能量,故A错误;
B.如△H-T•△S<0,则反应可自发进行,吸热反应和熵减的反应难以自发进行,故B错误;
C.如正逆反应速率相等,则平衡不移动,故C错误;
D.反应热取决于反应物与生成物的总能量,与反应的条件和途径无关,故D正确.
故选D.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力和基本理论知识的考查,注意理解反应热、焓变的相关概念,难度不大.

练习册系列答案
相关题目
15.在1LK2SO4和CuSO4的混合溶液中,C(SO42-)=2mol•L-1,用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
19.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 2.4 g镁在足量的O2中燃烧,转移的电子数为0.1 NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2 NA | |
| C. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| D. | 常温常压下,8 g O3中含有8 NA个电子 |
9.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
18.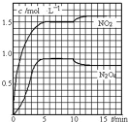 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH${\;}_{4}^{+}$+OH-,如果增大NH${\;}_{4}^{+}$的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
 +(2n-1)H2O.
+(2n-1)H2O.