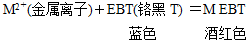题目内容
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸氢钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.1g,溶于水中,配成250mL溶液.
a.方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w(Na2CO3).
(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是 (填编号).
A.CaCl2 B.MgSO4 C.NaCl D.Ba(0H)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作 .
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有 .
(4)洗涤沉淀,简述洗涤沉淀的操作 .
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3).如果此步中,沉淀未干燥充分就称量,则测得w(Na2CO3) (填偏大或偏小、无影响).
b.方案二:滴定法测w(Na2CO3)量取25.00mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000mol/L的盐酸进行滴定到终点.重复此操作2次,消耗盐酸的体积平均值为20.00mL.[已知饱和的碳酸溶液PH为3.9]
(1)量取25.00mL配制好的溶液,应选择 仪器来完成.
(2)判断滴定终点的依据是 ,此过程中反应的离子方程式为 .
(3)此法测得w(Na2CO3)= %(保留两位小数).
a.方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w(Na2CO3).
(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是
A.CaCl2 B.MgSO4 C.NaCl D.Ba(0H)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有
(4)洗涤沉淀,简述洗涤沉淀的操作
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3).如果此步中,沉淀未干燥充分就称量,则测得w(Na2CO3)
b.方案二:滴定法测w(Na2CO3)量取25.00mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000mol/L的盐酸进行滴定到终点.重复此操作2次,消耗盐酸的体积平均值为20.00mL.[已知饱和的碳酸溶液PH为3.9]
(1)量取25.00mL配制好的溶液,应选择
(2)判断滴定终点的依据是
(3)此法测得w(Na2CO3)=
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:方案一:(1)滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,关键是该沉淀剂能够与碳酸氢根离子反应生成沉淀;
(2)可以直接向原溶液中加入氢氧化钡溶液,根据反应现象判断HCO3-、CO32-是否沉淀完全;
(3)根据过滤操作的方法判断需要使用的仪器名称;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,据此判断对测定结果的影响;
方案二:(1)碳酸钠、碳酸氢钠的混合液显碱性,应该用碱式滴定管量取;
(2)酚酞的变色范围是8.2~10.0,反应结束时溶液由红色突变为无色,据此判断滴定终点;反应方程式为:H++CO32-=HCO3-;
(3)根据反应H++CO32-=HCO3-计算出50 mL样品溶液中含有的碳酸钠的物质的量,然后计算出250mL样品溶液中含有的碳酸钠的物质的量,再根据m=nM计算出碳酸钠的质量,最后根据质量分数的表达式计算出样品中碳酸钠的质量分数.
(2)可以直接向原溶液中加入氢氧化钡溶液,根据反应现象判断HCO3-、CO32-是否沉淀完全;
(3)根据过滤操作的方法判断需要使用的仪器名称;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,据此判断对测定结果的影响;
方案二:(1)碳酸钠、碳酸氢钠的混合液显碱性,应该用碱式滴定管量取;
(2)酚酞的变色范围是8.2~10.0,反应结束时溶液由红色突变为无色,据此判断滴定终点;反应方程式为:H++CO32-=HCO3-;
(3)根据反应H++CO32-=HCO3-计算出50 mL样品溶液中含有的碳酸钠的物质的量,然后计算出250mL样品溶液中含有的碳酸钠的物质的量,再根据m=nM计算出碳酸钠的质量,最后根据质量分数的表达式计算出样品中碳酸钠的质量分数.
解答:
解:方案一:(1)A.CaCl2溶液只能与碳酸根反应转化为碳酸根沉淀,故A错误;
B.MgSO4溶液与HCO3-、CO32-均不反应,故B错误;
C.NaCl溶液与HCO3-、CO32-都不反应,故C错误;
D.Ba(OH)2溶液与HCO3-、CO32-都发生反应生成碳酸钡沉淀,故D正确;
故答案为:D;
(2)要证明HCO3-、CO32-已完全沉淀,则可以继续滴加氢氧化钡溶液,即正确的实验操作方法为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全,
故答案为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全;
(3)过滤操作所需要的玻璃仪器有:烧杯、玻璃棒、普通漏斗,故答案为:烧杯、玻璃棒、普通漏斗;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次,故答案为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)如果此步中,沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小,故答案为:偏小;
方案二:(1)溶液显碱性,因此应该用碱式滴定管量取,故答案为:碱式滴定管;
(2)酚酞的变色范围是8.2~10.0,所以判断滴定终点的依据是由红色突变为无色,且30s不恢复,发生的离子方程式为:H++CO32-=HCO3-,
故答案为:由红色突变为无色,且30s不恢复;H++CO32-=HCO3-;
(3)反应达到终点时,发生的离子方程式为:H++CO32-=HCO3-,
则根据消耗盐酸的体积可知20.00ml可知,消耗碳酸钠的物质的量为:0.2000 mol/L×0.02000L=0.004mol,
则原混合物中碳酸钠的物质的量为:0.004mol×
=0.04mol,质量为:0.04mol×106g/mol=4.24g,
所以碳酸钠质量分数为:
×100%=83.14%,
故答案为:83.14.
B.MgSO4溶液与HCO3-、CO32-均不反应,故B错误;
C.NaCl溶液与HCO3-、CO32-都不反应,故C错误;
D.Ba(OH)2溶液与HCO3-、CO32-都发生反应生成碳酸钡沉淀,故D正确;
故答案为:D;
(2)要证明HCO3-、CO32-已完全沉淀,则可以继续滴加氢氧化钡溶液,即正确的实验操作方法为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全,
故答案为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全;
(3)过滤操作所需要的玻璃仪器有:烧杯、玻璃棒、普通漏斗,故答案为:烧杯、玻璃棒、普通漏斗;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次,故答案为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)如果此步中,沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小,故答案为:偏小;
方案二:(1)溶液显碱性,因此应该用碱式滴定管量取,故答案为:碱式滴定管;
(2)酚酞的变色范围是8.2~10.0,所以判断滴定终点的依据是由红色突变为无色,且30s不恢复,发生的离子方程式为:H++CO32-=HCO3-,
故答案为:由红色突变为无色,且30s不恢复;H++CO32-=HCO3-;
(3)反应达到终点时,发生的离子方程式为:H++CO32-=HCO3-,
则根据消耗盐酸的体积可知20.00ml可知,消耗碳酸钠的物质的量为:0.2000 mol/L×0.02000L=0.004mol,
则原混合物中碳酸钠的物质的量为:0.004mol×
| 250mL |
| 25mL |
所以碳酸钠质量分数为:
| 4.24 |
| 5.1 |
故答案为:83.14.
点评:本题考查碳酸钠和碳酸氢钠混合物中碳酸钠含量测定的实验方案设计与评价,题目难度中等,明确化学实验基本操作方法及碳酸钠、碳酸氢钠的性质为解答此题关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
下列反应的离子方程正确的是( )
| A、硫酸溶液中加入氢氧化钡溶液 Ba2++SO42-=BaSO4↓ |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钠溶液中加入足量盐酸 CO32-+2H+=CO2↑+H2O |
| D、铝片与硝酸汞溶液反应 Al+Hg2+=Al 3++Hg |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
下列物质的用途,利用氧化还原反应的是( )
| A、用氯气消毒浴池 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: