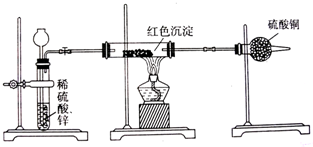
题目内容
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
考点:物质的分离、提纯和除杂
专题:化学实验基本操作
分析:A.氢氧化钠能与苯酚生成苯酚钠;
B.C2H4与酸性高锰酸钾反应生成二氧化碳气体;
C.乙酸乙酯在碳酸钠溶液中等溶解度很小;
D.硫化氢能与硫酸铜反应生成硫化铜和硫酸.
B.C2H4与酸性高锰酸钾反应生成二氧化碳气体;
C.乙酸乙酯在碳酸钠溶液中等溶解度很小;
D.硫化氢能与硫酸铜反应生成硫化铜和硫酸.
解答:
解:A.氢氧化钠能与苯酚生成苯酚钠,然后分液即可分离,故A正确;
B.C2H4与酸性高锰酸钾反应生成二氧化碳气体,引入新杂质,应用溴水除杂,故B错误;
C.乙酸乙酯在碳酸钠溶液中等溶解度很小,能用分液漏斗进行分离,故C正确;
D.硫化氢能与硫酸铜反应生成硫化铜和硫酸,可以除去杂质,故D正确.
故选B.
B.C2H4与酸性高锰酸钾反应生成二氧化碳气体,引入新杂质,应用溴水除杂,故B错误;
C.乙酸乙酯在碳酸钠溶液中等溶解度很小,能用分液漏斗进行分离,故C正确;
D.硫化氢能与硫酸铜反应生成硫化铜和硫酸,可以除去杂质,故D正确.
故选B.
点评:本题考查化学实验方案的评价,侧重于物质的分离的考查,题目难度中等,除杂时注意不能引入新的杂质,特别是不能影响被提纯的物质.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |
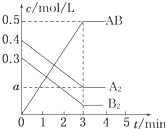 一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )| A、图中a点的值为0.15 |
| B、该反应的平衡常数K=0.03 |
| C、温度升高,平衡常数K值减小 |
| D、平衡时A2的转化率为62.5% |
下列现象或应用不能用胶体知识解释的是( )
| A、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| B、长江三角洲的形成 |
| C、氯化铝溶液中加入NaOH溶液会产生白色沉淀 |
| D、盐水点豆腐 |
测定稀盐酸和氢氧化钠稀溶液中和热的实 验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
| A、②⑤⑦⑧ | B、①②⑥⑦ |
| C、②③⑦⑧ | D、③④⑤⑦ |