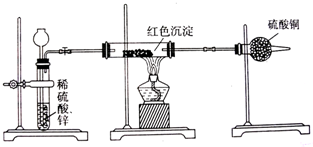
题目内容
铝热反应曾用于钢轨焊接,也用于金属冶炼.铝热反应实验时,在固体混合物中间插入一根镁带.
(1)实验时,镁带的作用是 ;
(2)氧化铁和铝粉反应的化学方程式为 ;
(3)当该反应中有0.3mol电子发生转移时,参加反应的氧化铁的质量为 g.
(4)该反应 (填“吸”或“放”)热,说明反应物总能量 (填“大于”或“小于”)生成物总能量.
(1)实验时,镁带的作用是
(2)氧化铁和铝粉反应的化学方程式为
(3)当该反应中有0.3mol电子发生转移时,参加反应的氧化铁的质量为
(4)该反应
考点:探究铝热反应
专题:
分析:(1)金属镁燃烧会放出大量的热,为铝热反应提供反应条件;
(2)氧化铁和铝之间发生反应生成金属铁和氧化铝;
(3)根据元素化合价的升降结合反应中氧化铁的物质的量来计算电子转移情况;
(4)根据反应生成的铁是液态,确定反应是放热的,反应物和生成物的能量高低可以确定反应的吸放热情况.
(2)氧化铁和铝之间发生反应生成金属铁和氧化铝;
(3)根据元素化合价的升降结合反应中氧化铁的物质的量来计算电子转移情况;
(4)根据反应生成的铁是液态,确定反应是放热的,反应物和生成物的能量高低可以确定反应的吸放热情况.
解答:
解:(1)在铝热反应中,金属镁燃烧会放出大量的热,为铝热反应提供反应条件,所以镁带的作用是:燃烧放出的热为铝热反应提供能量,故答案为:燃烧放出的热为铝热反应提供能量;
(2)氧化铁和铝之间发生反应生成金属铁和氧化铝,反应的化学方程式为2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3;
(3)反应2Al+Fe2O3
2Fe+Al2O3中,有6mol电子发生转移时,参加反应的氧化铁的物质的量是1mol,当有0.3mol电子发生转移时,参加反应的氧化铁的物质的量是0.05mol,质量是0.05mol×160g/mol=8g,故答案为:8;
(4)铝热反应生成的铁是液态,则反应是放热的,反应物的能量高于生成物的能量,故答案为:放热;高于.
(2)氧化铁和铝之间发生反应生成金属铁和氧化铝,反应的化学方程式为2Al+Fe2O3
| ||
| ||
(3)反应2Al+Fe2O3
| ||
(4)铝热反应生成的铁是液态,则反应是放热的,反应物的能量高于生成物的能量,故答案为:放热;高于.
点评:本题考查学生铝热反应的原理以及氧化还原反应中化合价变化和电子转移之间的关系知识,属于综合知识的考查,难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
将0.01molNa2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为( )克.
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A、将样品配制成溶液V1 L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL |
| B、向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C、将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g |
| D、将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |
下列现象或应用不能用胶体知识解释的是( )
| A、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| B、长江三角洲的形成 |
| C、氯化铝溶液中加入NaOH溶液会产生白色沉淀 |
| D、盐水点豆腐 |