题目内容
W、X、Y、Z 为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素.X和Z为同族元素.Y和W的最外层电子数相等.Y、Z两元素原子的质子数之和为 W、X 两元素质子数之和的3倍.由此可知:
(1)写出元素符号:X为 ,Y为
(2)W2Z是由 键组成的分子,其电子式为 .
(3)由W、X、Y、Z 四种元素组成的化合物的化学式有 和 两种.
(1)写出元素符号:X为
(2)W2Z是由
(3)由W、X、Y、Z 四种元素组成的化合物的化学式有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢),因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,W的质子数是1,X和Z为同族元素,设X的质子数为x,则Z的质子数为x+8,Y、Z两元素原子的质子数之和为 W、X 两元素质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即X为O,Z为S,所以W、X、Y、Z分别为:H,O,Na,S,据此答题;
解答:
解:短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢),因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,W的质子数是1,X和Z为同族元素,设X的质子数为x,则Z的质子数为x+8,Y、Z两元素原子的质子数之和为 W、X 两元素质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即X为O,Z为S,所以W、X、Y、Z分别为:H,O,Na,S,
(1)根据上面的分析可知,X、Y分别为:O,Na,
故答案为:O;Na;
(2)W2Z是H2S,H与S之间通过共价键结合,属于共价化合物,电子式为 ,
,
故答案为:共价; ;
;
(3)由W、X、Y、Z 四种元素组成的化合物有NaHSO4和NaHSO3,
故答案为:NaHSO4;NaHSO3;
(1)根据上面的分析可知,X、Y分别为:O,Na,
故答案为:O;Na;
(2)W2Z是H2S,H与S之间通过共价键结合,属于共价化合物,电子式为
 ,
,故答案为:共价;
 ;
;(3)由W、X、Y、Z 四种元素组成的化合物有NaHSO4和NaHSO3,
故答案为:NaHSO4;NaHSO3;
点评:本题考查原子结构与元素周期律的关系、元素的推断,题目难度中等,正确推断元素的种类为解答该题的关键,解题时注意常见化学用语的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |
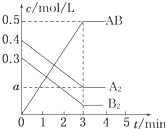 一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )| A、图中a点的值为0.15 |
| B、该反应的平衡常数K=0.03 |
| C、温度升高,平衡常数K值减小 |
| D、平衡时A2的转化率为62.5% |
