题目内容
4.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
分析 A、分子个数N=$\frac{V}{{V}_{m}}{N}_{A}$;
B、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
C、二氧化硫所处的压强不明确;
D、分子个数N=$\frac{m}{M}{N}_{A}$.
解答 解:A、标况下5.6L氧气中含有的氧气分子个数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{5.6L}{22.4L/mol}×{N}_{A}/mol$=0.25NA=n1,故NA=4n1,故A正确;
B、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁转移0.2NA个电子,故B错误;
C、二氧化硫所处的压强不明确,故气体摩尔体积不明确,故二氧化硫的物质的量和分子个数无法计算,故C错误;
D、18g水中含有的分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{18g}{18g/mol}×{N}_{A}/mol$=NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.只用一种试剂,将分别含有 Fe3+、Al3+、Mg2+、NH4+等阳离子的四种溶液区分开,这种试剂是( )
| A. | NaOH 溶液 | B. | NaCl 溶液 | C. | KSCN 溶液 | D. | 氨水 |
15.“类比法”是化学学习中的一种常用方法.下列说法正确的是( )
| A. | CO2 能使漂白粉水溶液先变浑浊后变澄清,SO2 也有同样现象 | |
| B. | 加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
12.标准状况下将4.48LCO2通人1L0.3mol•L-1NaOH溶液中,当CO2与NaOH完全反应时,下列说法正确的是( )
| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
19.某有机物A分子式为C9H10O2,其水解后产物可以使FeCl3溶液变紫色,则A的同分异构体有( )
| A. | 6种 | B. | 7种 | C. | 13种 | D. | 16种 |
9.下列有机物的命名正确的是( )
| A. | 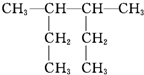 3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 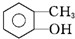 邻甲基苯酚 邻甲基苯酚 | |
| D. | 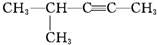 2-甲基-3-戊炔 2-甲基-3-戊炔 |
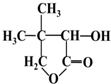 其合成路线如下:
其合成路线如下: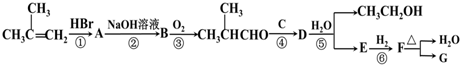
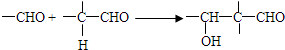
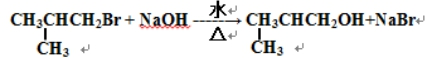 .
. .
.