题目内容
19.某有机物A分子式为C9H10O2,其水解后产物可以使FeCl3溶液变紫色,则A的同分异构体有( )| A. | 6种 | B. | 7种 | C. | 13种 | D. | 16种 |
分析 有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,其水解后产物可以使FeCl3溶液变紫色,说明生成物中含有酚,则分子内含一个苯环、属于酯,故含有苯环、酯基,结合取代基的不同分析同分异构体;
解答 解:有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,其水解后产物可以使FeCl3溶液变紫色,说明生成物中含有酚,则分子内含一个苯环、属于酯;
若含有1个取代基,取代基为:-OOCCH2CH3,只有1种同分异构体;
若含有2个取代基,取代基为:-OOCCH3和-CH3;-OOCH和-CH2CH3,2个取代基分为邻、间、对三种结构,有6种同分异构体;
若含有3个取代基,取代基为:-OOCH和-CH3,-CH3,二甲苯有邻、间、对3种结构,用-OOCH分别取代苯环上的1个氢原子,则分别有2种、3种、1种,共有6种同分异构体;
所以A的同分异构体有13种,
故选C.
点评 本题考查同分异构体的书写,题目难度不大,判断取代基是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列叙述正确的是( )
| A. | 只由非金属元素组成的离子不一定都是阴离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属元素原子最外层电子数越少,金属性越强 |
10.把200mlNH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a molNaOH的溶液恰好反应完全;取另一份加入含b molHCl的盐酸恰好反应完全.该混合溶液中c(Na+)为( )
| A. | (10b-5a)mol•L- | B. | (2b-a)mol•L- | C. | ($\frac{b}{10}$-$\frac{a}{20}$)mol•L- | D. | (5b-$\frac{5a}{2}$)mol•L- |
7.下列原子或原子团中,不属于官能团的是( )
| A. | -OH | B. | -CHO | C. | -H | D. | -COOH |
4.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
4.下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
| A. | ①③⑤ | B. | ①④ | C. | ②③ | D. | ①②④ |
5.工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置.实验时按如下步骤操作:
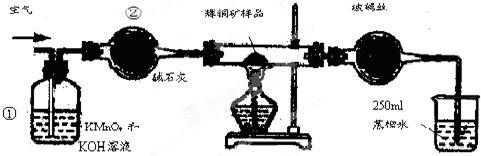
实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低(写一种即可).
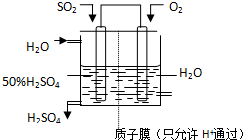
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.