题目内容
5.某兴趣小组探究以芒硝Na2SO4•10H2O和CaO为原料制备Na2CO3.(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3.三元体系中反应的离子方程式为:SO42-+Ca(OH)2(s)+2H2O?CaSO4•2H2O(s)+2OH-该反应的平衡常数表达式K=$\frac{c(O{H}^{-})^{2}}{c(S{{O}_{4}}^{2-})}$.往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3[即c(OH-)=0.02mol/L],可使反应在常温下容易进行.反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3.
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是碱性条件下CO2与Ca2+生成难溶物CaCO3.
(3)添加的酸性物质须满足的条件(写出两点)是不与Ca2+生成难溶物、酸性比碳酸弱.
(4)用平衡移动原理解释添加酸性物质的理由:酸性物质与OH-反应,使平衡向生成CaSO4•2H2O的方向进行;
以HA表示所添加的物质,则总反应的离子方程式可写为SO42-+Ca(OH)2+2HA?CaSO4•2H2O↓+2A-.
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法错误的是ad.
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小
d.稀释溶液,平衡常数增大.
分析 (1)根据平衡常数的表达式写出该反应的平衡常数表达式;
(2)由于在碱性条件下,CO2与Ca2+生成难溶物CaCO3;
(3)添加的酸性物质不能与Ca2+生成难溶物、酸性比碳酸弱;
(4)氢离子能够中和氢氧根离子,使平衡向生成CaSO4•2H2O的方向进行;HA的酸性比碳酸酸性弱,写成分子式;
(5)a、加水溶液碱性减小,氢氧根离子浓度减小,氢离子浓度减小;
b、通入CO2,生成HCO3-;
c、氢氧化钠中的氢氧根离子抑制了碳酸钠水解;
d、温度不变,水解平衡常数不变.
解答 解:(1)根据平衡常数表达式,反应SO42-+Ca(OH)2(s)+2H2O?CaSO4•2H2O(s)+2OH-的平衡常数表达式为:K=$\frac{c(O{H}^{-})^{2}}{c(S{{O}_{4}}^{2-})}$,
故答案为:$\frac{c(O{H}^{-})^{2}}{c(S{{O}_{4}}^{2-})}$;
(2)在碱性条件下CO2与Ca2+生成难溶物CaCO3,所以不直接通入CO2,
故答案为:碱性条件下CO2与Ca2+生成难溶物CaCO3;
(3)添加的酸性物质酸性要比碳酸的弱,且不能与钙离子生成沉淀,这样才能生成硫酸钙晶体,
故答案为:不与Ca2+生成难溶物;酸性比碳酸弱;
(4)加入酸性物质,氢离子可以中和氢氧根离子,使平衡向着生成CaSO4•2H2O的方向进行;以HA表示所添加的酸性物质,由于HA酸性要小于碳酸酸性,反正方程式中应该写成分子式,所以总反应的离子方程式为SO42-+Ca(OH)2+2HA?CaSO4•2H2O↓+2A-,
故答案为:酸性物质与OH-反应,使平衡向生成CaSO4•2H2O的方向进行;SO42-+Ca(OH)2+2HA?CaSO4•2H2O↓+2A-;
(5)a、加水溶液碱性减小,氢氧根离子浓度减小,氢离子浓度减小,由于氢离子和氢氧根离子浓度的乘积相同,所以氢离子浓度增大,故a错误;
b、通入CO2,生成HCO3-;由于HCO3-的水解程度小于CO32-的水解程度,所以溶液碱性减小,PH减小,故b正确;
c、氢氧化钠中的氢氧根离子抑制了碳酸钠水解,所以CO32-的浓度增大,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小,故c正确;
d、温度不变,水解平衡常数不变,故d错误;
故答案为:ad.
点评 本题考查了硫酸钙晶体的制取,涉及了化学平衡常数表达式书写、试剂选择等知识,是一道比较综合的练习,难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案| A. | Fe2+ | B. | Mg2+ | C. | Fe3+ | D. | Al3+ |
| A. | CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu | |
| B. | CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2═2Cu+2HCl | |
| C. | CuH在稀硝酸反应的化学方程式为CuH+3HNO3═Cu(NO3)2+NO↑+2H2O | |
| D. | CuH受热分解的化学方程式为2CuH═2Cu+H2↑ |
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
| A. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
| A. | Cl2→NaClO | B. | Fe2O3→Fe(OH)3 | C. | Na→Na2SO4 | D. | Cu→CuCl2 |
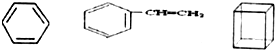 组成的混合物中碳的质量分数为92.3%.
组成的混合物中碳的质量分数为92.3%.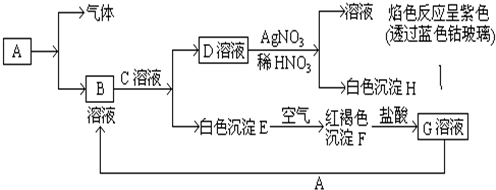
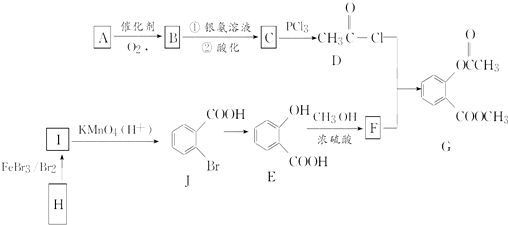
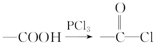
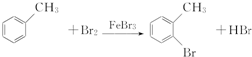 ,E→F的化学方程式为
,E→F的化学方程式为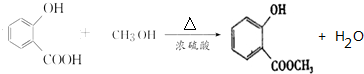 .
.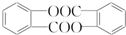 .
.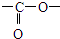 ”结构
”结构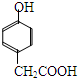 .
.