题目内容
12.标准状况下将4.48LCO2通人1L0.3mol•L-1NaOH溶液中,当CO2与NaOH完全反应时,下列说法正确的是( )| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
分析 反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n (CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=1L×0.3mol/L=0.3mol,
则有:2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3,溶液中存在的主要阴离子有CO32-、HCO3-,由此分析解答.
解答 解:反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n (CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=1L×0.3mol/L=0.3mol,
则有:2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3,溶液中存在的主要阴离子有CO32-、HCO3-,
A、阴离子有CO32-、HCO3-,故A错误;
B、设碳酸钠的物质的量为xmol,则碳酸氢钠的物质的量为(0.2-x)mol,根据钠守恒可知:2x+0.2-x=0.3解之得x=0.1,所以溶液中溶质的物质的量之比为1:1,故B错误;
C、溶液中存在有碳酸根,说明CO2不足,故C错误;
D、溶液中存在有碳酸根,所以反应后的溶液还可以吸收部分CO2,故D正确;
故选D.
点评 本题考查化学方程式的相关计算,题目难度不大,注意正确判断产物的成分为解答该题的关键.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
3.可以证明氯化钠是离子化合物的是( )
| A. | 固态氯化钠不导电 | B. | 液态氯化钠能导电 | ||
| C. | 氯化钠易溶于水 | D. | 氯化钠溶液能导电 |
7.下列原子或原子团中,不属于官能团的是( )
| A. | -OH | B. | -CHO | C. | -H | D. | -COOH |
17.已知氢化亚铜(CuH)是一种难溶、易分解的物质,能与稀盐酸反应,Cu+在酸性条件下发生反应2Cu+═Cu2++Cu,下列有关说法不正确的是( )
| A. | CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu | |
| B. | CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2═2Cu+2HCl | |
| C. | CuH在稀硝酸反应的化学方程式为CuH+3HNO3═Cu(NO3)2+NO↑+2H2O | |
| D. | CuH受热分解的化学方程式为2CuH═2Cu+H2↑ |
4.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
18.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品中Fe元素的质量为2.24 g | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
 下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).
下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).
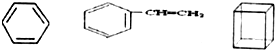 组成的混合物中碳的质量分数为92.3%.
组成的混合物中碳的质量分数为92.3%.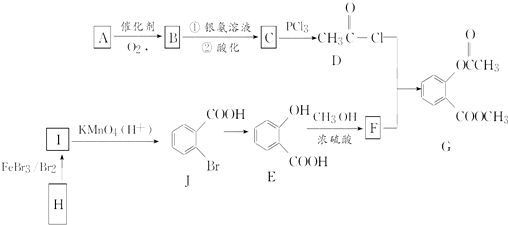
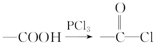
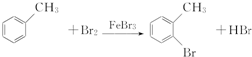 ,E→F的化学方程式为
,E→F的化学方程式为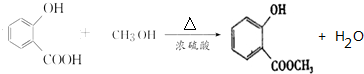 .
.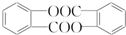 .
.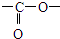 ”结构
”结构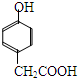 .
.