题目内容
10.(1)用5.0mol/L的NaOH溶液配制0.1mol/L的NaOH溶液时,如图所示的仪器中,肯定不需要的是ABCE(填序号),配制上述溶液还需要的玻璃仪器是玻璃棒、胶头滴管、量筒(填仪器名称).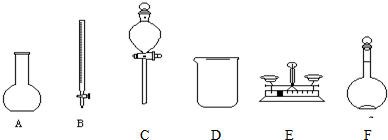
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)①③④.
①准确取出的浓NaOH溶液在空气中露置时间过长
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切
③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切
④稀释NaOH溶液的仪器未洗涤.
分析 (1)根据溶液的配制情况结合各仪器的作用选取仪器;
(2)根据配制一定物质的量浓度的溶液操作方法对c=$\frac{n}{V}$的影响分析产生的误差.
解答 解:(1)用5.0mol/L的NaOH溶液配制0.1mol/L的NaOH溶液的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,使用的仪器有:量筒、烧杯、胶头滴管、容量瓶、玻璃杯等,选项中用到的仪器有:D、F,一定不会使用的仪器有:A、B、C、E,还缺少玻璃杯、胶头滴管和量筒,
故答案为:ABCE,玻璃棒、胶头滴管、量筒;
(2)①准确取出的浓NaOH溶液在空气中露置时间过长,导致氢氧化钠变质,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故①正确;
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切,该操作方法合理,不影响溶液浓度,故②错误;
③摇匀后,液面低于刻度线,属于正常现象,不需要加入蒸馏水,若再加蒸馏水至液面最低点恰好和环形刻度线相切,导致配制的溶液体积偏大,溶液浓度偏低,故③正确;
④稀释NaOH溶液的仪器未洗涤,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故④正确;
故答案为:①③④.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,明确配制步骤为解答关键,注意掌握误差分析的方法与技巧,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
4.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
1.下列变化过程中,需要吸收能量的是( )
| A. | Br+Br→Br-Br | B. | H-F→H+F | C. | H2+Cl2→HCl | D. | Cs(金刚石)→Cs(石墨) |
18.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品中Fe元素的质量为2.24 g | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
5.工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置.实验时按如下步骤操作:
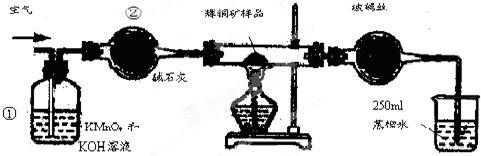
实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低(写一种即可).
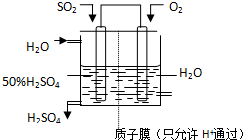
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

15.下列转化关系不能一步实现的是( )
| A. | Cl2→NaClO | B. | Fe2O3→Fe(OH)3 | C. | Na→Na2SO4 | D. | Cu→CuCl2 |
20.锗(Ge)是第4周期ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
| A. | 锗是一种金属性很强的元素 | B. | 锗酸(H4GeO4)是难溶于水的强酸 | ||
| C. | 锗化氢(GeH4)稳定性很强 | D. | 锗的单质具有半导体的性能 |