题目内容
15.“类比法”是化学学习中的一种常用方法.下列说法正确的是( )| A. | CO2 能使漂白粉水溶液先变浑浊后变澄清,SO2 也有同样现象 | |
| B. | 加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
分析 A.CO2 能使漂白粉水溶液先发生强酸制取弱酸的反应生成碳酸钙沉淀,碳酸钙与二氧化碳、水反应生成碳酸氢钙,而SO2与漂白粉溶液发生氧化还原反应生成硫酸钙沉淀;
B.Li与O2反应只生成Li2O;
C.常温下,浓硝酸、浓硫酸均能使铁、铝钝化;
D.Na与硫酸铜溶液反应生成硫酸钠、氢气、氢氧化铜.
解答 解:A.CO2 能使漂白粉水溶液先变浑浊后变澄清,而SO2 与漂白粉水溶液发生氧化还原反应生成白色沉淀,故A错误;
B.加热条件下,Na与O2反应生成Na2O2,而Li与O2反应也生成氧化锂,故B错误;
C.常温下,浓硝酸、浓硫酸均能使铁、铝钝化,生成致密的氧化膜阻止反应的进一步发生,故C正确;
D.铁可置换出硫酸铜溶液中的铜,而Na不能置换出硫酸铜溶液中的铜,Na先与水反应,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
5.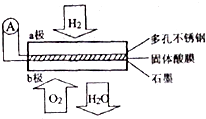 某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
 某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | 电池工作时,化学能主要转化为电能 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4mol电子,生成3.6g水 | |
| D. | H+由b极通过固体酸电解质传递到a极 |
6.在甲、乙、丙三溶液中各有一种X-(X-为Cl-、Br-、I-离子),向乙中加入淀粉溶液和氯水,溶液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙三溶液中依次含有( )
| A. | Br-、I-、Cl- | B. | Cl-、Br-、I- | C. | I-、Br-、Cl- | D. | I-、Cl-、Br- |
3.可以证明氯化钠是离子化合物的是( )
| A. | 固态氯化钠不导电 | B. | 液态氯化钠能导电 | ||
| C. | 氯化钠易溶于水 | D. | 氯化钠溶液能导电 |
10.把200mlNH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a molNaOH的溶液恰好反应完全;取另一份加入含b molHCl的盐酸恰好反应完全.该混合溶液中c(Na+)为( )
| A. | (10b-5a)mol•L- | B. | (2b-a)mol•L- | C. | ($\frac{b}{10}$-$\frac{a}{20}$)mol•L- | D. | (5b-$\frac{5a}{2}$)mol•L- |
7.下列原子或原子团中,不属于官能团的是( )
| A. | -OH | B. | -CHO | C. | -H | D. | -COOH |
4.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
1.下列变化过程中,需要吸收能量的是( )
| A. | Br+Br→Br-Br | B. | H-F→H+F | C. | H2+Cl2→HCl | D. | Cs(金刚石)→Cs(石墨) |
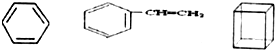 组成的混合物中碳的质量分数为92.3%.
组成的混合物中碳的质量分数为92.3%.