题目内容
13.在100mL混合酸中,c(HNO3)=0.4mol•L-1,c(H2SO4)=0.2mol•L-1,向其中加入 2.56g铜粉,加热待充分反应后,溶液中 Cu2+的物质的量浓度为0.3mol/L.分析 根据反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O先判断过量,再进行计算解答.
解答 解:在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量n(H2SO4)=0.1L×0.2moL/L=0.02moL,
所以氢离子的物质的量n(H+)=0.04moL+2×0.02moL=0.08mol,
铜粉的物质的量=$\frac{2.56g}{64g/mol}$=0.04mol,依据方程式:
3Cu+2NO3 -+8H+=3Cu2++2NO+4H2O
3 2 8
0.04mol 0.04mol 0.08mol
可知氢离子不足,故根据H+计算,由方程式可知n(Cu2+)=$\frac{3}{8}$×0.08mol=0.03mol,
所以C(Cu2+)=$\frac{0.03mol}{0.1L}$=0.3mol/L,
故答案为:0.3mol/L.
点评 本题考查了硝酸的相关计算,题目难度不大,解题时注意依据离子反应方程式计算解答.

练习册系列答案
相关题目
3.反应A2(g)+B2(g)=2AB(g)的能量变化如图,下列叙述中正确的是( )


| A. | 该反应的焓变为△H=+(a-b) kJ/mol | |
| B. | 加入催化剂只能减小a而不能改变b的大小 | |
| C. | 加入催化剂可使反应热效应逆转,从而易于进行 | |
| D. | 断裂1molA-A和1molB-B键,放出a kJ能量 |
1.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式: | B. | CH2F2的电子式: | ||
| C. | 对硝基甲苯的结构简式: | D. | 异丙醇的结构简式:CH3CH2CH2OH |
5.下列关于Na20与Na2O2的说法中,不正确的是( )
| A. | Na2O2比Na20化学性质稳定 | |
| B. | 均与水反应生成NaOH,因而均是碱性氧化物 | |
| C. | Na20能被氧化成Na2O2 | |
| D. | 均可与H2O、CO2反应 |
2.胶体的特性是( )
| A. | 有丁达尔现象 | B. | 加热会聚沉 | C. | 电泳 | D. | 胶状 |
17.试剂瓶上贴有 标志的物质是( )
标志的物质是( )
 标志的物质是( )
标志的物质是( )| A. | 浓硫酸 | B. | NaCl溶液 | C. | NH4Cl溶液 | D. | Na2SO4溶液 |
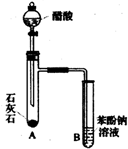 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.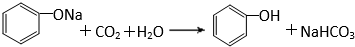 .
. 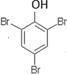 .
.
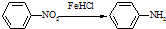 (苯胺,易被氧化)
(苯胺,易被氧化)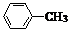 .
.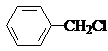 .
.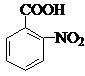 .反应②③两步能否互换不能,(填“能”或“不能”)理
.反应②③两步能否互换不能,(填“能”或“不能”)理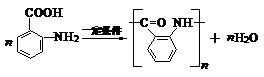 ;反应⑤的化学方程式是
;反应⑤的化学方程式是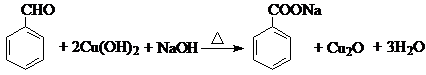 .
.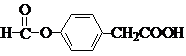 .
.