题目内容
17.如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )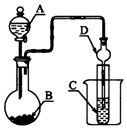
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
分析 A.浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫为酸性氧化物,使石蕊变红;
B.醋酸与碳酸钙反应生成二氧化碳,二氧化碳使石灰水变浑浊;
C.浓盐酸与二氧化锰反应需要加热;
D.浓氨水与生石灰混合可生成氨气,氨气与氯化铝溶液反应生成氢氧化铝沉淀.
解答 解:A.浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫为酸性氧化物,使石蕊变红,则C中盛石蕊溶液,则C中溶液变红,故A错误;
B.醋酸与碳酸钙反应生成二氧化碳,二氧化碳使石灰水变浑浊,则C中盛过量澄清石灰水,则C中溶液变浑浊,故B正确;
C.浓盐酸与二氧化锰反应需要加热,则不能生成氯气,C中盛品红溶液,则C中溶液不褪色,故C正确;
D.浓氨水与生石灰混合可生成氨气,氨气与氯化铝溶液反应生成氢氧化铝沉淀,则C中盛AlCl3溶液,则C中产生白色沉淀,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验、性质实验及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
7.下列物质不属于氧化物的是( )
| A. | MgO | B. | HClO | C. | Cu2O | D. | ClO2 |
12.下列电离方程式中,正确的是( )
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
15.四种短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3:4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
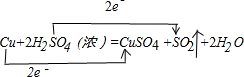 .
.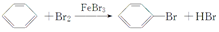 ,
,