题目内容
4.把金属钠投入到下列稀溶液中,溶液质量会减轻的是( )| A. | HCl | B. | (NH4)2SO4 | C. | CaCl2 | D. | CuSO4 |
分析 钠和水反应生成氢氧化钠和氢气,会出现气体,如果溶液质量减轻,则说明从溶液中放出气体的质量大于溶液增加的质量,根据金属钠和下列物质间的反应情况来解答.
解答 解:A.钠和盐酸的反应方程式为:2Na+2HCl═2NaCl+H2↑,根据方程式知,溶液增加的质量=m(Na)-m(H2),溶液质量增加,故A错误;
B.钠和NH4NO3的反应方程式为:2Na+2HCl═2NaCl+H2↑,(NH4)2SO4+2NaOH=2NH3↑+Na2SO4+2H2O,(23-17-2)×2>0,所以溶液质量增加,故B错误;
C.将金属钠加入到CaCl2溶液中,只有金属钠和水之间反应,钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,根据方程式知,溶液增加的质量=m(Na)-m(H2),溶液质量增加,故C错误;
D.钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应,方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓,将两个方程式相加:2Na+2H2O+CuSO4═H2↑+Na2SO4+Cu(OH)2↓,由方程式知,溶液的质量减轻,故D正确;
故选:D.
点评 本题考查了钠及氢氧化钠的性质,难度不大,注意根据方程式运用差量法分析反应后溶液质量的变化即可.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
15.四种短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3:4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
12.下列离子方程式中,正确的是( )
| A. | 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
19.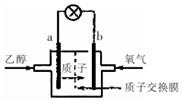 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
9.下列说法正确的是( )
| A. | 100℃时,某溶液pH=6,则该溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液中c(SO32-)<c(H2SO3) | |
| C. | 25℃时,pH=3的硫酸溶液与pH=11的氨水等体积混合,所得溶液呈酸性 | |
| D. | 室温下,10mL0.1mol/L CH3COOH溶液与5mLO.lmol/LNaOH溶液混合,所得溶液中有:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
13.光导纤维已成为信息社会必不可少的高技术材料,用于制造光导纤维的物质是( )
| A. | Si | B. | SiO2 | C. | Na2SiO3 | D. | CaSiO3 |


 则该化合物的化学式为MgCNi3(用对应的元素符号表示).
则该化合物的化学式为MgCNi3(用对应的元素符号表示).
 .
.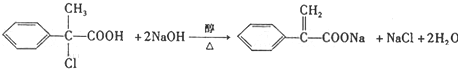 .
.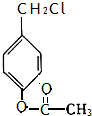 、
、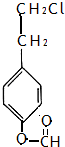 .
.