题目内容
12.肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸汽通入CuO胶体中,可发生如图所示的转化
(1)图示的转化中,属于非氧化还原反应的是②(填序号).
(2)转化①中,氧化剂与还原剂的物质的量之比为4:1,则X的化学式为N2.
(3)转化②中,反应一段时间后,溶液中m(OH-)增大(填“增大”“减小”或“不变”)
(4)加入NaClO时发生的反应为Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H3↑+2Cl-+2H2O.该反应需在80℃以上进行,其目的除加快反应速率外,还有使氢氧化铜分解、降低肼的溶解度,促使其从溶液中逸出.
(5)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为1:8.
分析 (1)非氧化还原反应即无元素化合价变化的反应;
(2)在反应①中,N2H4做还原剂,CuO做氧化剂,根据氧化剂与还原剂的物质的量之比为4:1,据此分析X;
(3)发生Cu2O+4NH3•H2O=2Cu(NH3)2++2OH-+3H2O,碱性增强;
(4)温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(5)反应③4Cu(NH3)2++8NH3+2H2O+O2=4Cu(NH3)42++4OH-、④Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O,反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,根据转移电子守恒计算.
解答 解:(1)非氧化还原反应即无元素化合价变化的反应,反应②中铜元素、氮元素和氢元素以及氧元素的化合价均没有变化,故为非氧化还原反应,
故答案为:②;
(2)在反应①中,N2H4做还原剂,CuO做氧化剂,则X为氧化产物,设X中氮元素为a价,则根据氧化剂与还原剂的物质的量之比为4:1有:4×(2-1)=1×2×(a-2+2),可解得a=0,即X为氮气,
故答案为:N2;
(3)转化②中的离子方程式为:Cu2O+4NH3•H2O=2Cu(NH3)2++2OH-+3H2O,故溶液中氢氧根的物质的量增大,溶液中m(OH-)增大,
故答案为:增大;
(4)温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,即该反应需在80℃以上进行,降低肼的溶解度,促使其从溶液中逸出,
故答案为:使氢氧化铜分解;降低肼的溶解度,促使其从溶液中逸出;
(5)在整个转化过程中满足铜元素的守恒,故若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,
反应③4Cu(NH3)2++8NH3+2H2O+O2=4Cu(NH3)42++4OH-,若①中参加反应的CuO物质的量为0.4mol,根据铜元素的守恒,参加n[Cu(NH3)2+]=0.4mol,
参加反应的O2的物质的量n(O2)=0.1mol,反应④Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O,根据铜元素的守恒,参加n[Cu(NH3)42+]=0.4mol,则④中参加反应的NaClO的物质的量n(NaClO)=0.8mol,所以③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为1:8,
故答案为:1:8.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,(5)注意计量数与物质的量变化量关系,为该题解答难点,题目难度中等.


| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
| A. | 原子半径Y>Z,离子半径Z-<M2+ | |
| B. | MX2与水发生反应时,MX2只做氧化剂 | |
| C. | X、Y形成的化合物既能与强酸反应又能与强碱反应 | |
| D. | MX2、MZ2两种化合物中,阳离子与阴离子个数比均为1:2 |
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”、“不变”).其理由是氢氧化钠固体溶于水放热.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
| 装置 | 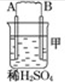 | 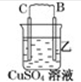 | 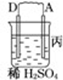 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)四种金属活泼性由强到弱的顺序是D>A>B>C.
(4)A、C形成合金,露置在潮湿空气中,A先被腐蚀.



 .
.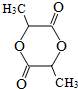 .
.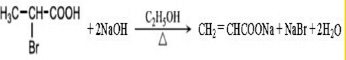 .
. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).