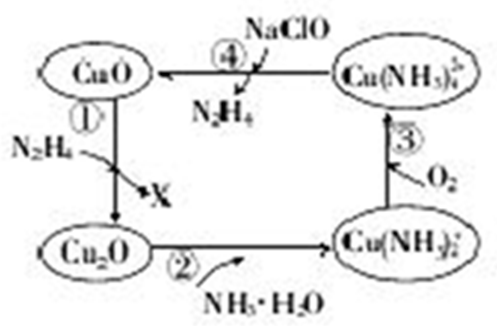
题目内容
4.在1000mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假定电解后溶液体积仍为 1000mL,下列说法正确的是( )| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),
则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
阳极发生4OH--4e-═O2↑+2H2O,
n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
阳极发生4OH--4e-═O2↑+2H2O,
2mol 0.5mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
0.5mol 1mol 0.5mol 1mol 0.5mol
A.电解后溶液中c(H+)为$\frac{2-1}{1}$=1mol/L,故A错误;
B.由上述分析可知,电解过程中转移电子总数为2NA,故B错误;
C.电解得到的Cu的物质的量为0.5mol,故C错误;
D.c(Cu2+)=$\frac{0.5mol}{1L}$=0.5mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-0.5mol/L×2=5mol/L,故D正确;
故选D.
点评 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,选项D为学生解答的难点,注意氢氧根离子与氢离子的关系即可解答.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14.常温下,等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙.下列判断合理的是( )
| A. | 甲一定是强碱 | B. | 乙一定是弱碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
15.下列各对物质中,互为同系物的是( )
| A. | CH3-CH═CH2与  | B. | 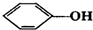 与 与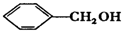 | ||
| C. | HCOOC2H5与CH3COOCH3 | D. | 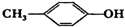 与 与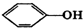 |
19.实验探究是体验知识的产生和形成过程的基本途径.如表是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2═2NaCl+Br2.
③中反应的离子方程式为Cl2+2I-═2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 | 实验结论 氧化性从强到弱的顺序:氯、溴、碘 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2═2NaCl+Br2.
③中反应的离子方程式为Cl2+2I-═2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).
9.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,且B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
13.下列说法正确的是( )
| A. | KW随浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
14.一定温度下,反应A2(气)+B2(气)?2AB(气)达到化学平衡状态的标志是( )
| A. | 单位时间生成 n mol 的 A2,同时生成 n mol 的 AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间生成2n mol 的 AB,同时生成n mol 的 B2 | |
| D. | 单位时间生成n mol 的 A2,同时生成n mol 的 B2 |